Какие прививки стоит сделать перед поездкой в теплые страны
Популярные у россиян курорты постепенно открываются, и чтобы попасть на некоторые из них, требуется прививка от COVID-19. Однако не стоит забывать, что коронавирус — не единственная напасть, поджидающая в тропических странах. В ряде государств фиксируются заражения и другими смертельными заболеваниями. Так, в Таиланде и на Мальдивах циркулируют несколько видов лихорадок, а в Африке до сих пор есть случаи заболевания холерой. О том, как обезопасить себя перед поездкой в теплые страны, — в материале «Газеты.Ru».
Случаи заболевания лихорадкой денге зафиксированы в Новосибирске – инфекцию в город завезли туристы, сообщил руководитель управления Роспотребнадзора по региону Александр Щербатов.
«Очередные случаи есть. Отдыхали жители города Новосибирска на Мальдивах и в итоге — укусы комаров и произошел завоз. Внутреннего распространения лихорадка не получает», — сказал он на оперативном совещании.
Пока по всему мира проводится массовая вакцинация от COVID-19, некоторые туристы забывают, что на большинстве тропических курортов циркулируют и другие не менее опасные инфекции.
Так, по данным Всемирной организации здравоохранения (ВОЗ), лихорадка денге переносится москитами, которые поражены флавивирусом (вирус желтой лихорадки). Данная болезнь существует в более чем 100 странах – в частности, в Таиланде, Вьетнаме, Индонезии, Индии, Кубе, Бангладеш, Гонконге, Мальдивских островах и Бразилии. При этом темпы ее распространения очень велики, отмечают в организации. Ежегодно в мире регистрируется от 50 до 100 млн случаев инфекции.
У заразившихся резко повышается температура, начинает болеть голова, возникает боль в мышцах и суставах, а также наблюдаются кашель, сыпь и тонзиллит. Кроме того, заболевание может вызвать потенциально летальную геморрагическую лихорадку с кровотечением и шоком.
Вместе с тем существует вакцина от этого заболевания, разработанная компанией Sanofi Pasteur. Впервые она была зарегистрирована в декабре 2015 года в Мексике для применения у лиц в возрасте от 9 до 45 лет, проживающих в районах с наиболее частыми случаями инфекции.
Тем не менее ВОЗ не рекомендует ее использовать. Дело в том, что выпуск вакцины спровоцировал большую эпидемию на Филиппинах — уровень антител у привитых повышался, но при этом не заболевали только те, кто уже перенес инфекцию. В свою очередь люди, которые раньше не болели, получив препарат, заболевали тяжелой формой лихорадки денге с летальностью в 50%.
В связи с этим, основная стратегия, которую применяют для контроля и предотвращения распространения вируса денге, заключается в борьбе с переносчиками инфекции.
Тем же туристам, которые хотят обезопасить себя перед полетом в тропическую страну, лучше сделать прививку от желтой лихорадки, которая имеет генетическое родство с вирусом денге, считают в ВОЗ.
Вакцина от желтой лихорадки является безопасной и недорогостоящей. При этом одна доза вакцины достаточна для формирования пожизненного иммунитета без необходимости ревакцинации.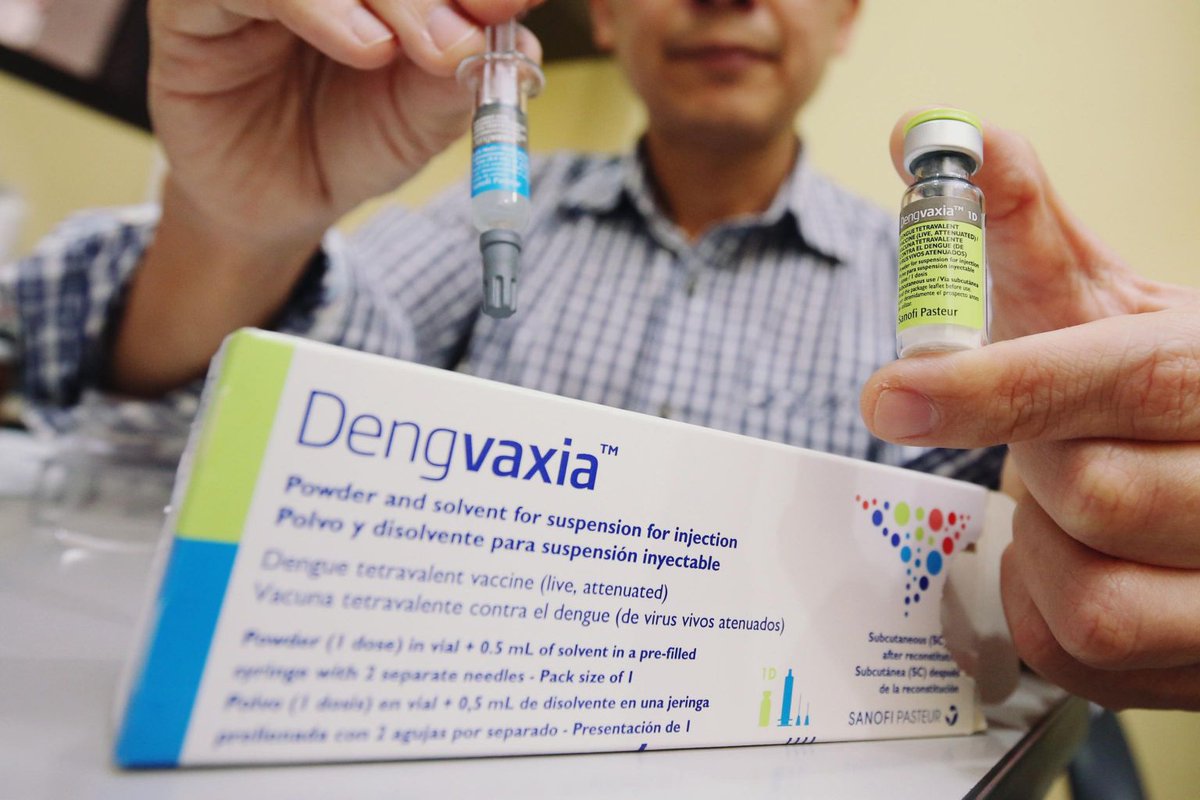
К слову, заразиться самой желтой лихорадкой можно на отдыхе в Африке, а также Южной и Северной Америке. Так, например в Бразилии с декабря 2016 года и по настоящее время фиксируется вспышка данной болезни среди населения 24 муниципальных районов, передает Минздрав страны.
В то же время в Азии, Африке и Латинской Америке до сих пор фиксируют случаи заболевания холерой — острой диарейной инфекцией, возникающей при употреблении пищевых продуктов или воды, зараженных бактерией. Инфекция может привести к быстрому обезвоживанию организма и смерти.
Имеется два типа вакцины для профилактики холеры. Как правило, рекомендуется оральное применение двух или трех доз, тем не менее в некоторых регионах мира препарат доступен и в форме инъекции. По данным ВОЗ, в 85% случаев защитное действие прививок длится в течение первых шести месяцев, а в 50-60% — в течение первого года после вакцинации.
Кроме того, одной из основных туристических болезней является малярия, замечают в ВОЗ. Она вызывается паразитами рода Plasmodium – они передаются людям через укусы инфицированных самок комаров.
Она вызывается паразитами рода Plasmodium – они передаются людям через укусы инфицированных самок комаров.
Большинство случаев заболевания и смерти от нее фиксируют в Африке, к югу от Сахары. Однако риску также подвергаются такие регионы, как Юго-Восточная Азия, Восточное Средиземноморье, Западная часть Тихого океана и Америка.
В большинстве случаев, если не начать лечение в течение первых 24 часов, малярия может развиться в тяжелую болезнь, часто приводящую к летальному исходу.
Тем не менее прививки от малярии не существует. Единственный способ уменьшить риск заражения — избегать укусов комаров. Для этого нужно использовать репелленты, спать под противомоскитной сеткой и носить одежду с длинными рукавами.
Между тем перед отлетом в южные страны медики также рекомендуют всем туристам привиться от гепатита А, брюшного тифа, японского энцефалита, менингококковой инфекции, бешенства и клещевого энцефалита. Об этом сообщается на сайте Центра по контролю и профилактике заболеваний США.
Лихорадка денге охватила Филиппины – Наука – Коммерсантъ
Лихорадка денге, тропическая инфекция с летальностью — при геморрагическом синдроме — до 50%, быстро распространяется по Филиппинам: с начала года зафиксировано свыше 140 тыс. случаев, свыше 600 человек умерло.
Правительство Филиппин объявило эпидемию лихорадки денге и взялось за радикальные меры: поскольку переносчиком вируса выступают комары (вида желтолихорадочный кусака, Aedes Aegipti, он же переносит, понятное дело, желтую лихорадку, лихорадку Зика и т. п.), места их размножения решено обработать химикатами. Решение неплохое, но во-первых, несвоевременное, а во-вторых, комары эти способны размножаться даже в пластиковой коробочке из-под какой-нибудь еды.
Лихорадка денге (она же костоломная лихорадка или финиковая болезнь) после Второй мировой войны широко распространилась по миру. Ею в год болеет не менее 50 млн человек, а в плохие годы — до 500 млн человек, умирают десятки тысяч. Лечения от нее никакого нет — точнее, только симптоматическое. Если болезнь не принимает геморрагической формы (когда массовые кровоизлияния в органах и тканях быстро приводят к летальному исходу),— прогноз вполне благополучный. Начало болезни похоже на тяжелый грипп: ломит суставы, резко поднимается температура, может возникнуть рвота; по телу распространяется сыпь, увеличиваются и вызывают болезненность лимфатические узлы. Спустя пять-семь дней лихорадка проходит, боли стихают; но примерно у десятой доли больных возникает геморрагический синдром, и тогда течение болезни может продолжаться несколько недель.
Если болезнь не принимает геморрагической формы (когда массовые кровоизлияния в органах и тканях быстро приводят к летальному исходу),— прогноз вполне благополучный. Начало болезни похоже на тяжелый грипп: ломит суставы, резко поднимается температура, может возникнуть рвота; по телу распространяется сыпь, увеличиваются и вызывают болезненность лимфатические узлы. Спустя пять-семь дней лихорадка проходит, боли стихают; но примерно у десятой доли больных возникает геморрагический синдром, и тогда течение болезни может продолжаться несколько недель.
У лихорадки денге есть несколько неприятных особенностей, главная из которых — вирус имеет пять разных серотипов. То есть один и тот же человек может пять раз болеть лихорадкой денге. Повторное заражение, но другим серотипом денге, делает течение заболевания гораздо более тяжелым, чем первичное: наличие антител к другому серотипу усложняет иммунный ответ организма. (Далекая и не совсем верная аналогия: у родителей с разным резус-фактором каждому следующему ребенку приходится все трудней в утробе. )
)
На серологическую особенность лихорадки денге налетела компания Sanofi. Прежний президент Филиппин Бенигно Акино Третий (он же Нойной Акино) уговорился с французскими фармацевтами о национальной кампании прививок против денге. Вакцина под названием Dengvaxia на тот момент (2015 год, декабрь) была гордостью Sanofi: компания потратила на ее разработку 1,5 млрд евро и собиралась выручать от ее мировых продаж по 1 млрд евро в год; иными словами, ожидался отличный бизнес.
Филиппины, первая страна, решившая привить население от денге, для начала закупила вакцины почти на 65 млн евро. Прививку получило свыше 700 тыс. филиппинцев, в основном подростки и дети.
Дальше начались неприятности. Оказалось, что привитые филиппинцы, если они до прививки болели каким-нибудь вариантом лихорадки денге, переносят прививку, мягко сказать, плохо. Появились даже сообщения (окончательно не подтвержденные), будто по меньшей мере в четырех случаях прививка стала причиной гибели привитых подростков.
В общем, министерство здравоохранения Филиппин уже к концу 2017 года прекратило прививочную кампанию. Заведено несколько уголовных и гражданских дел, результатов пока нет; ведется, периодически прерываясь, по крайней мере одно парламентское расследование.
Обвинения звучали и в адрес Sanofi, но к легальным последствиям это не привело.
Неудача прививочной кампании против лихорадки денге имела еще одно чрезвычайно прискорбное последствие – филиппинцы массово стали отказываться от коревой вакцины. Результат не заставил себя долго ждать: в 2019 г., в феврале, в стране началась эпидемия кори, количество случаев в годовом сопоставлении выросло в 6,5 раз! Почти 200 человек умерло.
Помимо Филиппин кратный рост заболеваемости лихорадкой денге зафиксирован в Малайзии (около 63 тыс. больных, свыше 50 умерших) и во Вьетнаме (свыше 80 тыс. больных, четверо умерших). Невиданная эпидемия развернулась и в Бангладеш, где медицинская система не дает даже точной статистики заболеваемости лихорадкой денге.
Анатолий Кривов
Марк Головизнин о том, что не все вакцины одинаково полезны — Реальное время
Так что стоит подождать момента, когда появится уверенность в ее безвредности, считает Марк Головизнин
«Пульмонолог Минздрава по ЦФО профессор Андрей Малявин сказал, что не будет прививаться раньше 2021 года. Вакцина должна пройти все необходимые клинические испытания, тогда она будет безвредной. За столетнюю историю прививок выработался алгоритм: сначала это лабораторные испытания, затем многократные испытания на животных для определения необходимой дозы вакцины, а затем уже испытания на добровольцах и в клинике. От лабораторного этапа и конструкции вакцины до ее внедрения в практику проходит обычно 2—3 года», — утверждает кандидат медицинских наук, доцент МГМСУ Марк Головизнин. В колонке, написанной для «Реального времени», он рассуждает о том, должно ли быть поголовным применение вакцины от COVID-19 и как избежать повторения истории с вакциной от лихорадки денге на Филиппинах.
Что такое вакцина? Это ослабленный болезнетворный агент или его части, которые намеренно вводятся в здоровый организм для профилактики более тяжелого течения болезни. Вакцины применяются в мире уже более ста лет, и все это время существуют какие-то осложнения после прививок. И тем не менее актуально ставить вопрос не «какие осложнения дают вакцины», а «какие люди дают патологические реакции на вакцины». Если вакцина сделана с полным соблюдением технологий, то причины осложнений не в ней, а в конкретном человеке. Есть люди, которые в силу наследственных или приобретенных факторов могут иметь тяжелые осложнения от прививок. Легкие, безвредные для здоровья реакции могут появляться у значительной части вакцинированных.
Осложнения возникают в первую очередь из-за аллергии. Еще с довоенных времен ХХ века в мире известен термин «сывороточная болезнь». У ряда больных, которым вводили вакцину, развивалось это тяжелое осложнение. Оно выражается в поражении почек, легких, суставов и связано с тем, что белковые компоненты вакцины не удаляются вовремя клетками-фагоцитами. А другая причина осложнений — это врожденные иммунодефициты. Таким детям нельзя прививать живые вакцины типа БЦЖ. Вакцина БЦЖ — это живой ослабленный патогенный штамм бактерии туберкулеза. Но если у ребенка иммунодефицит, то даже этот безобидный штамм может вызвать заболевание по типу туберкулеза. Но и иммунодефицит, и аллергическую предрасположенность можно заранее прогнозировать. Сейчас стоит вопрос о том, что вакцинация должна иметь персонализированный подход.
У ряда больных, которым вводили вакцину, развивалось это тяжелое осложнение. Оно выражается в поражении почек, легких, суставов и связано с тем, что белковые компоненты вакцины не удаляются вовремя клетками-фагоцитами. А другая причина осложнений — это врожденные иммунодефициты. Таким детям нельзя прививать живые вакцины типа БЦЖ. Вакцина БЦЖ — это живой ослабленный патогенный штамм бактерии туберкулеза. Но если у ребенка иммунодефицит, то даже этот безобидный штамм может вызвать заболевание по типу туберкулеза. Но и иммунодефицит, и аллергическую предрасположенность можно заранее прогнозировать. Сейчас стоит вопрос о том, что вакцинация должна иметь персонализированный подход.
Сама вакцина не несет абсолютного зла, иначе бы мы их не применяли. В мире поняли, что, несмотря на ряд осложнений от вакцин, если вакцинацию отменить, то последствия будут гораздо тяжелее и для общественного здоровья, и для государственного бюджета, который вынужден будет содержать много новых больных и инвалидов.
В октябре 2019 года интернет пестрел объявлениями на разных порталах, что Минздрав опубликовал список смертельно опасных вакцин. На самом деле это была внутренняя методическая разработка для медиков, попавшая в руки журналистов. В ней просто анализировались все возможные осложнения от традиционных вакцин, которые применяются уже почти 100 лет. Туда попали известные вакцины против коклюша, столбняка и дифтерии (АКДС), БЦЖ, против кори. В этой методичке говорилось, что у ряда людей могут быть осложнения от вакцинации либо легкие, либо тяжелые. И врач должен определять для каждого человека показания к вакцинации. Такая же информация содержится и в тех огромных инструкциях, которые прилагаются к современным препаратам, продающимся в аптеке. Она предназначена для того, чтобы люди не занимались самолечением.
Сейчас принято, что если при клинических испытаниях лекарства у одного из 100 тысяч возникает тяжелое осложнение, то об этом нужно написать в инструкции. И уже врач должен соотнести степень риска и пользы. Но ведь у нас самолечение давно в ходу. И поэтому нередко больные, начитавшись таких инструкций, наотрез отказываются применять препарат, потому что там написано, что может быть инфаркт миокарда. И объяснить, что он был у одного из 100 тысяч, уже практически невозможно. Тем не менее объяснять надо — это тоже задача врача, как и в отношении вакцинации.
И уже врач должен соотнести степень риска и пользы. Но ведь у нас самолечение давно в ходу. И поэтому нередко больные, начитавшись таких инструкций, наотрез отказываются применять препарат, потому что там написано, что может быть инфаркт миокарда. И объяснить, что он был у одного из 100 тысяч, уже практически невозможно. Тем не менее объяснять надо — это тоже задача врача, как и в отношении вакцинации.
В советские времена у нас была всеобщая вакцинация. Это имело свои большие позитивные последствия, но при этом медицина у нас, да и в мире тоже, была во многом авторитарной: если врач что-то сказал, то надо именно так и делать. Сейчас медицина партнерская: пациент имеет право задавать вопросы, выбирать, кто его будет лечить, отказаться от лечения или дать информированное согласие на него.
Вакцина — это не лекарство отчаянияСамая опасная вакцина — это та, которая не прошла установленных клинических испытаний. Об этом стоит поговорить в связи с нынешней ситуацией. За столетнюю историю прививок выработался алгоритм испытаний вакцины. Сначала это лабораторные испытания, затем многократные испытания на животных для определения необходимой дозы вакцины, а затем уже испытания на добровольцах и в клинике. От лабораторного этапа и конструкции вакцины до ее внедрения в практику проходит обычно 2—3 года. Как показывает история вакцинации, вспышки осложнений, не связанных с индивидуальной непереносимостью, были связаны с нарушениями вакцинной технологии. Так было в Германии в 1930 году, когда вместо БЦЖ детям по ошибке был введен патогенный штамм. Тогда 70 человек умерло от туберкулеза.
За столетнюю историю прививок выработался алгоритм испытаний вакцины. Сначала это лабораторные испытания, затем многократные испытания на животных для определения необходимой дозы вакцины, а затем уже испытания на добровольцах и в клинике. От лабораторного этапа и конструкции вакцины до ее внедрения в практику проходит обычно 2—3 года. Как показывает история вакцинации, вспышки осложнений, не связанных с индивидуальной непереносимостью, были связаны с нарушениями вакцинной технологии. Так было в Германии в 1930 году, когда вместо БЦЖ детям по ошибке был введен патогенный штамм. Тогда 70 человек умерло от туберкулеза.
О вакцине от COVID-19 говорят на протяжении всей пандемии. И чем дальше мы проходим через карантин, тем больше заявлений о том, что мы получим вакцину уже осенью этого года. 30 мая в СМИ была опубликована информация, что уже совсем скоро будет вакцина, которая вводится через нос.
Но вирус появился только в 2019 году. Должно уйти какое-то время на расшифровку его генетического аппарата, его белковой структуры, клинических симптомов болезни. Здесь встает вопрос: в какие сроки мы должны получить вакцину, которая пройдет все этапы проверки? На этот счет есть несколько тревожных высказываний авторитетных деятелей в медицине. В частности, академик Виталий Зверев заявил, что без досконального подтверждения безопасности вакцины угроза ее применения может быть смертельной. Академик Валерий Черешнев, президент российского общества иммунологов, сказал то же самое — что вакцина должна пройти все необходимые клинические испытания, тогда она будет безвредной. Здесь выше головы не прыгнешь. На это уходит время. Да, сейчас можно смоделировать какие-то этапы на компьютере, но это не отменяет необходимости экспериментальной проверки.
Здесь встает вопрос: в какие сроки мы должны получить вакцину, которая пройдет все этапы проверки? На этот счет есть несколько тревожных высказываний авторитетных деятелей в медицине. В частности, академик Виталий Зверев заявил, что без досконального подтверждения безопасности вакцины угроза ее применения может быть смертельной. Академик Валерий Черешнев, президент российского общества иммунологов, сказал то же самое — что вакцина должна пройти все необходимые клинические испытания, тогда она будет безвредной. Здесь выше головы не прыгнешь. На это уходит время. Да, сейчас можно смоделировать какие-то этапы на компьютере, но это не отменяет необходимости экспериментальной проверки.
Пульмонолог Минздрава по ЦФО профессор Андрей Малявин сказал недавно, что не будет прививаться раньше 2021 года, исходя из того, что вакцина — это не лекарство отчаяния, которое нужно, когда нет другого выхода.
Вакцина — это «ослабленная болезнь», которая вводится здоровым людям, и надо быть уверенным в ее безопасности.
Здесь уместно напомнить о недавней трагической ситуации, связанной с вакциной от лихорадки денге. Это было в 2017 году. Лихорадка денге — тяжелое заболевание, которым болеют миллионы людей. Заразиться ею можно несколько раз, нет пожизненного иммунитета, нет специфического лечения. Значительная часть людей тяжело переносит эту болезнь, но выздоравливают. Но есть так называемая тяжелая форма лихорадки денге, когда развиваются массивные кровоизлияния во внутренних органах, тромбозы сосудов, что мы видим и при тяжелом течении ковид-инфекции.
Фармацевтический гигант Sanofi потратил 10 лет на разработку живой вакцины от денге. Работы были закончены в 2015 году, а в 2016-м ВОЗ высказала опасения относительно возможных осложнений. Тем не менее правительство Филиппин, проигнорировав предупреждение ВОЗ, закупило эту вакцину на 60 млн долларов. Было привито примерно 700 тысяч детей и подростков. Оказалось, что привитые этой вакциной получали высокий уровень антител, это был формальный признак того, что вакцина работает.
Оказалось, что привитые этой вакциной получали высокий уровень антител, это был формальный признак того, что вакцина работает.
Сейчас тоже думают, что если в крови есть антитела к COVID-19, то значит, что у человека приобретен иммунитет, но на самом деле все сложнее.
С вакциной от лихорадки денге вышло следующее: да, уровень антител повышался, но при этом не заболевали только те, кто уже переболел этой инфекцией. А те люди, которые раньше не болели, получив прививку, заболевали тяжелой формой лихорадки денге с летальностью в 50%. И на Филиппинах начали умирать. Во-первых, стали приходить сообщения о смертях среди привитых детей — от 14 до 200 погибших по разным данным. Самое главное, в 2019 году на Филиппинах разразилась новая эпидемия лихорадки денге, причем заразилось гораздо больше людей, чем до применения вакцины. Использование вакцины было остановлено, но 60 млн долларов уже потрачены. При этом правительство и судебные органы Филиппин возбудили ряд уголовных дел как против чиновников, так и в отношении сотрудников фармкомпании.
В итоге произошел своеобразный эксперимент на людях. Его данные учитываются, и последние научные статьи говорят, что вакцина от денге должна быть усовершенствована: она должна поднимать не только уровень антител в крови, но и стимулировать клеточный иммунитет. Вакцину модифицируют, вводят туда белки, которые активировали бы клеточные рецепторы, чтобы предотвратить разгон иммунной системы (цитокиновый шторм). Но уже видно, что новая прививка — дело не самого ближайшего будущего. Кстати, эпидемия на Филиппинах имела и социальные последствия в виде массового отказа от других вакцинаций. Как результат — новая эпидемия кори у взрослых с двумя сотнями летальных исходов в прошлом году.
В наше время стоит вопрос: нужна ли вакцина от COVID-19 всем? И самое главное: будет ли она безвредной? Не повторит ли она историю с вакциной от лихорадки денге? И только ли при высоком уровне антител можно говорить о приобретенном иммунитете? Есть данные о том, что высокий уровень антител у зараженных COVID-19 — ненадежный показатель излечения от вируса. Он не означает, что человек никогда больше не заболеет инфекцией COVID-19.
Он не означает, что человек никогда больше не заболеет инфекцией COVID-19.
Уже фигурируют новости, что за отказ от вакцинирования будут налагаться штрафы. В преддверии выпуска вакцины от COVID-19 случай на Филиппинах требует самого детального разбора в России.
Сама по себе вакцина от COVID-19 необходима, но она должна пройти все необходимые этапы испытаний на животных, на добровольцах и в клиниках. На это должно уйти необходимое время, здесь опасно действовать как-то по-другому.
Нужно помнить про первый принцип врача, который говорит: «Не навреди». И высказывания очень уважаемых медицинских деятелей РАН, которые я привел выше, не должны быть проигнорированы.
Марк Головизнин
Справка
Марк Головизнин — кандидат медицинских наук, доцент кафедры внутренних болезней МГМСУ им. А.И. Евдокимова, член Совета ассоциации медицинских антропологов. Сфера научных интересов: иммунология, интердисциплинарные исследования, медицинская антропология.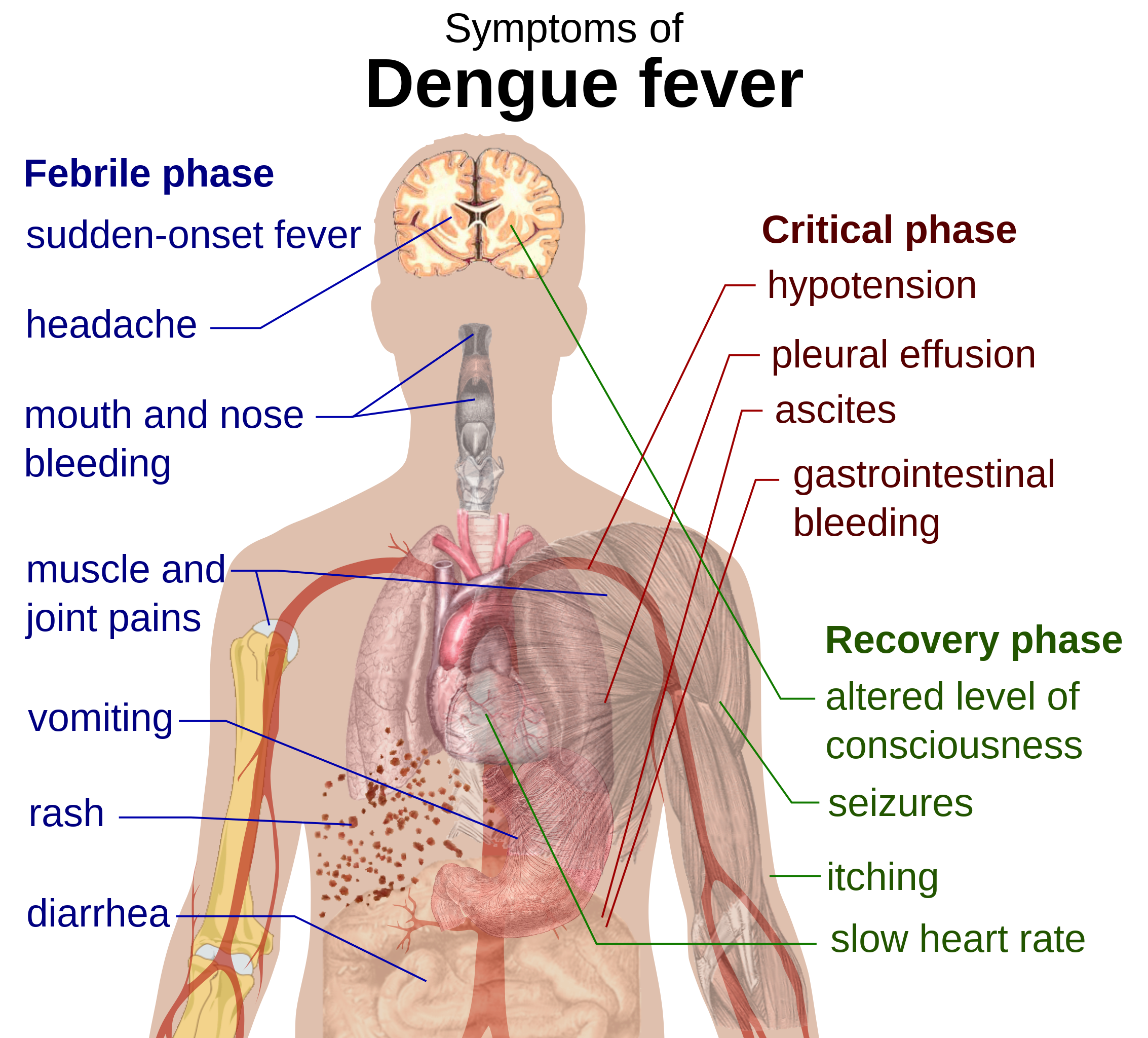
Мексика первой в мире разрешила применять вакцину от лихорадки денге
Фармацевтическая компания Sanofi получила разрешение на использование первой в мире вакцины от лихорадке денге в Мексике.
Это первая страна, которая одобрила вакцину Dengvaxia, которая подходит для всех четырех серотипов вируса денге.
Однако применять ее разрешили лишь для пациентов в возрасте от 9 до 45 лет, живущих в районах, в которых это заболевание часто встречается.
Пока что вакциной от лихорадки денге нельзя иммунизировать маленьких детей, которые находятся в зоне наибольшего риска для этой болезни, а также туристов.
В Sanofi пояснили, что пока не ясно, как скажется вакцина на приезжих — необходимо проанализировать статистику за несколько лет ее использования. Что же касается маленьких детей, то на них вакцина малоэффективна.
Французская компания также заявила, что до конца года подаст документы для одобрения вакцины в 20 стран — в основном это государства Южной Америки и Азии. Компания подаст заявку на одобрение вакцины в Европе в начале следующего году, а в США — в 2017 году.
В Sanofi назвали вакцину «инновацией десятилетия», пишет Франс пресс.
В Мексике с самого начала проходили клинические тесты вакцины, добавляет Рейтер. Всего в клинических тестах приняли участие 40 тысяч человек разного возраста и социально-экономического происхождения из 15 стран мира.
Вакцина снижает риск госпитализации заболевших на 80% и на 93% снижает вероятность развития геморрагического синдрома, который является самой тяжелой формой болезни.
Лихорадка денге переносится комарами. Болезнь представляет потенциальную угрозу примерно для половины мирового населения. Всемирная организация здравоохранения ставит своей целью снизить смертность от лихорадки на 50% к 2020 году, а сократить количество заражения — на 25%.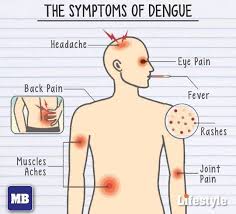
Reuters узнал об иммунитете к COVID-19 у переболевших лихорадкой денге :: Общество :: РБК
В районах, где ранее были вспышки денге, наблюдался медленный рост заболеваемости коронавирусной инфекцией. По мнению ученых, вакцина от лихорадки может дать иммунитет к COVID-19
Фото: Кирилл Зыков / АГН «Москва»
Те, кто перенес лихорадку денге, могут иметь определенный уровень иммунитета к коронавирусу COVID-19. Об этом сообщает Reuters со ссылкой на еще не опубликованное исследование, проведенное профессором американского Университета Дьюка Мигелем Николелисом.
Об этом сообщает Reuters со ссылкой на еще не опубликованное исследование, проведенное профессором американского Университета Дьюка Мигелем Николелисом.
Ученый, в частности, сравнил вспышки коронавируса и распространение лихорадки по географическому принципу. В итоге он выяснил, что в местах с более низкими показателями заражения коронавирусом и более медленным ростом заболеваемости в этом и прошлом годах отмечались интенсивные вспышки денге.
«Это поразительное открытие поднимает интригующую возможность иммунологической перекрестной реактивности между серотипами флавивируса денге и SARS-CoV-2», — говорится в исследовании.
Ученые выявили связь поисковых запросов с будущими вспышками COVID-19По словам Николелиса, если его гипотеза окажется верной, то заболевание лихорадкой денге или иммунизация вакциной против нее может обеспечить определенный уровень иммунологической защиты от коронавируса.
Вакцинация перед поездкой в Японию
Обязательной вакцинации не требуется
Однако разумно заранее сделать привычные рутинные прививки. В последние годы в стране зафиксированы случаи кори, краснухи и даже лихорадки денге (против которой нет вакцины).
Стоит заранее продумать, как минимизировать контакт с комарами в дождливые летние месяцы. Японский энцефалит — болезнь редкая, иногда со смертельным исходом, но от него можно сделать прививку. Если приезжаете ненадолго или в большие города — такие как Токио, Осаку, Киото — скорее всего, она вам не понадобится. При малейших вопросах или сомнениях лучше проконсультируйтесь с врачом до поездки.
Рутинные прививки стоит обновить
Что такое рутинная вакцинация?
Центры по контролю и профилактике заболеваний США (далее — CDC) советуют перед поездкой в Японию обновить следующие прививки:
Корь-паротит-краснуха (MMR, в России — КПК), дифтерия-столбняк-коклюш (DTaP, в России — АДС), ветряная оспа, полиомиелит.
Также в зависимости от конкретных планов на поездку рекомендуем оценить целесообразность следующих прививок:
Гепатит A (возможно заражение воды и еды)
Гепатит B (если собираетесь делать татуировки, вступать в половые контакты с новым партнёром или проходить любые медицинские процедуры)
Бешенство (если планируете спелеотуризм или походы в местах обитания летучих мышей))
Японский энцефалит (см. ниже)
Берегитесь комаров
Что такое японский энцефалит?
Японский энцефалит — вирусное заболевание, распространённое в западной Японии. Пик переноса — начало лета и осенние месяцы. Вирус переносится комарами, пьющими кровь заражённых птиц и млекопитающих. В связи с этим максимальному риску подвергаются работники и посетители рисовых полей, ирригационных систем и сельской местности в целом.
Возможные симптомы — лихорадка, сильные головные боли, диарея, рвота и общая слабость. Симптомы проявляются не у всех заражённых. В редких случаях возможен летальный исход. Лучшая защита от японского энцефалита — вакцинация и предотвращение укусов насекомых. Прививку необходимо сделать за определённое время до поездки. Подробности можно узнать у врача.
Симптомы проявляются не у всех заражённых. В редких случаях возможен летальный исход. Лучшая защита от японского энцефалита — вакцинация и предотвращение укусов насекомых. Прививку необходимо сделать за определённое время до поездки. Подробности можно узнать у врача.
Были ли в Японии эпидемии?
В Японии изредка случаются эпидемии инфекционных болезней. В последнее время фиксировались в основном краснуха и корь, однако в 2014 году был случай лихорадки денге. Расследование показало, что её переносчиками оказались комары из токийского парка Ёёги.
Приезжающим в страну рекомендуется соблюдать меры разумной предосторожности и иметь свежие прививки. Беременным женщинам, не привитым против краснухи, перед посещением Японии рекомендуется консультация врача.
Переполненный общественный транспорт — потенциальный рассадник инфекций
Сезон простуд и гриппа в Японии
Гриппозный сезон в Японии — зима (с декабря по март).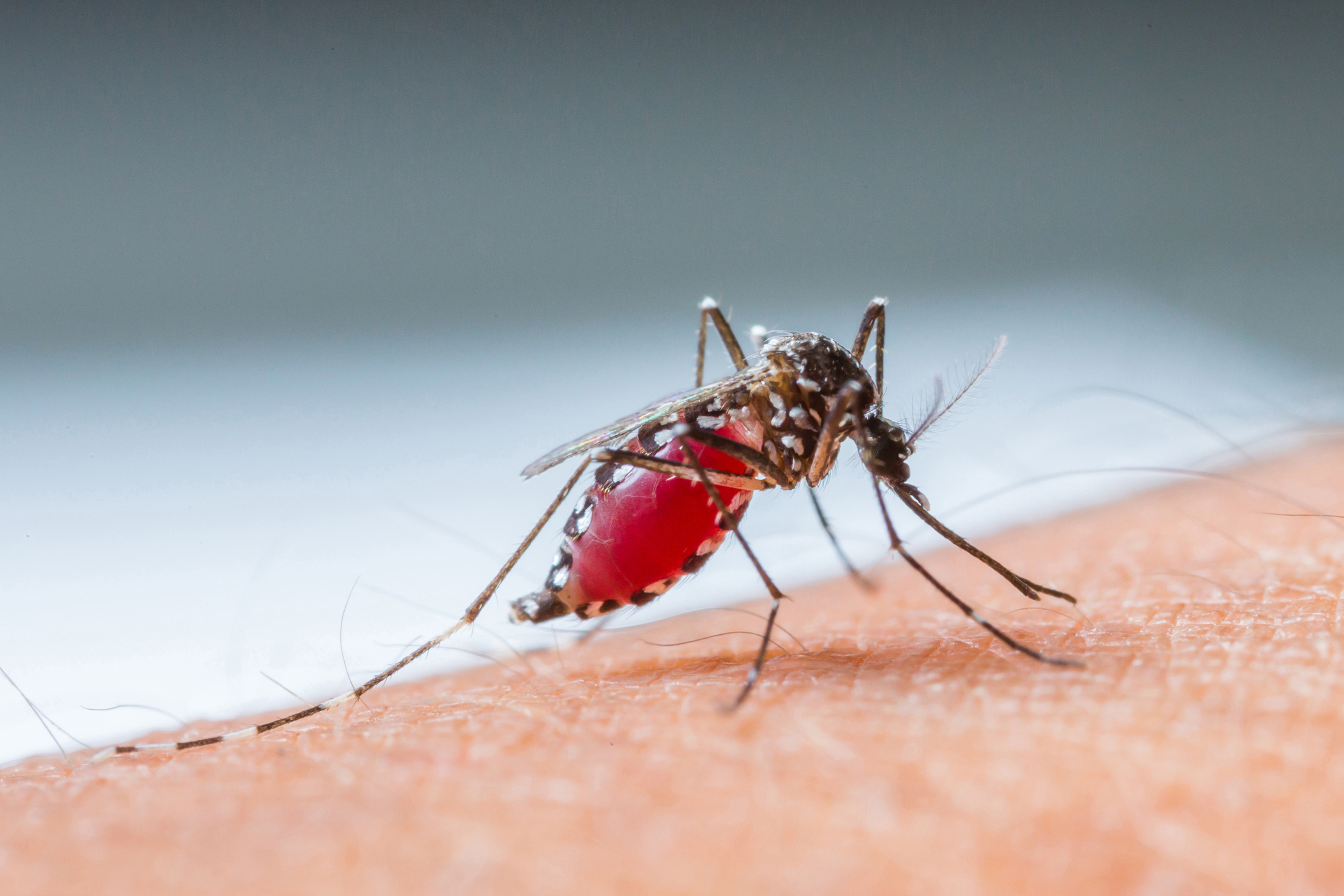 Города перенаселены, и вирус распространяется быстро. В 2018 году в стране случилась эпидемия гриппа — заразилось более 2,8 миллионов человек. CDC рекомендуют сделать ежегодную прививку против гриппа до поездки в Японию, особенно если едете зимой. Это снизит интенсивность симптомов в случае заражения.
Города перенаселены, и вирус распространяется быстро. В 2018 году в стране случилась эпидемия гриппа — заразилось более 2,8 миллионов человек. CDC рекомендуют сделать ежегодную прививку против гриппа до поездки в Японию, особенно если едете зимой. Это снизит интенсивность симптомов в случае заражения.
Что такое норовирус?
Норовирус, также известный как «норо» или «желудочный грипп» — ещё одно распространённое в зимний период инфекционное заболевание. Симптомы — рвота, диарея, в острых случаях — обезвоживание. Лучшая мера профилактики — частое мытьё рук.
Власти Филиппин объявили эпидемию лихорадки денге: от нее умерли более 600 человек | Громадское телевидение
По информации министерства здравоохранения страны, с января по 20 июля лихорадкой денге (острая инфекционная болезнь, передающаяся комарами) заболели более 146 тыс. человек — это на 98 процентов больше, чем в 2018 году. В наибольшей степени пострадали дети младше 10 лет, передает The Guardian.
Единственной доступной на рынке вакциной против денге является Dengvaxia производства французской Sanofi Pasteur. Компания попала в центр скандала на Филиппинах после того, как там в 2017 и 2018 годах умерли десятки детей, прошедших вакцинацию. В Sanofi Pasteur признали, что их продукт может подвергать риску маленьких детей.
Смерти после вакцинации привели к панике среди населения. Некоторые родители отказались ставить детям не только прививки от денге, но и от кори. В итоге в стране зарегистрировано уже более 35 тыс. случаев кори (на 600 процентов больше, чем годом ранее), 500 случаев из них — смертельные.
С целью борьбы со вспышкой денге, министерство здравоохранения начало кампанию по обработке мест наибольшего скопления комаров, для местного населения выпускают памятки с советами относительно ношения одежды.
Также в ведомстве обсуждают вопрос о возвращении Dengvaxia на рынок, только ставить вакцину будут детям не младше девяти лет, как и советует Всемирная организация здравоохранения.
Вспышка заболевания денге зарегистрирована и в других тропических странах. В Малайзии на конец июня было более 62 тысяч случаев, включая 93 смертельных. Во Вьетнаме — более 81 тыс. случаев и четыре смертельных. Показатели заболеваемости превышают прошлогодние в два и более раз.
Напомним, согласно результатам глобального исследования The Wellcome Trust, половина украинцев не верит в эффективность вакцинации. Это один из самых низких уровней доверия к прививкам в мире.
Глобальное исследование об отношении к прививкам охватило более 140 тыс. человек из 140 стран мира.
Всемирная организация здравоохранения считает отказ от вакцинации одной из 10 крупнейших угроз для здоровья человечества.
вакцина против лихорадки денге | Паспорт оздоровительной клиники
Что такое лихорадка денге?
Лихорадка денге — это болезнь, переносимая комарами, которая ежегодно поражает миллионы людей. Страны в тропиках часто больше всего страдают от болезни.
Хотя симптомы обычно «похожи на грипп», лихорадка денге может перерасти в геморрагическую лихорадку денге. Эта более серьезная форма заболевания может привести к летальному исходу, особенно для людей с ослабленным иммунитетом.
Эта более серьезная форма заболевания может привести к летальному исходу, особенно для людей с ослабленным иммунитетом.
Несколько вакцин против лихорадки денге в настоящее время находятся в стадии разработки или недавно были одобрены.Это поможет защитить тех, кто живет в пострадавших районах, и путешественников в эти регионы.
Что такое вакцина против лихорадки денге?
Вакцины против лихорадки денге предназначены для предотвращения распространения вируса денге через комаров или другими способами. В стадии разработки находится около пяти вакцин против денге. Но один был одобрен для использования в Мексике и Бразилии.
Dengvaxia® — первая вакцина против денге, одобренная для использования в профилактике лихорадки денге. Вскоре он поступит на рынок Бразилии и Мексики.Пока неизвестно, когда эта или другая вакцина от денге будет доступна в Соединенных Штатах.
Когда будет доступна вакцина против лихорадки денге?
Хотя Dengvaxia® скоро будет доступен в Бразилии и Мексике, график его выпуска в других странах отсутствует.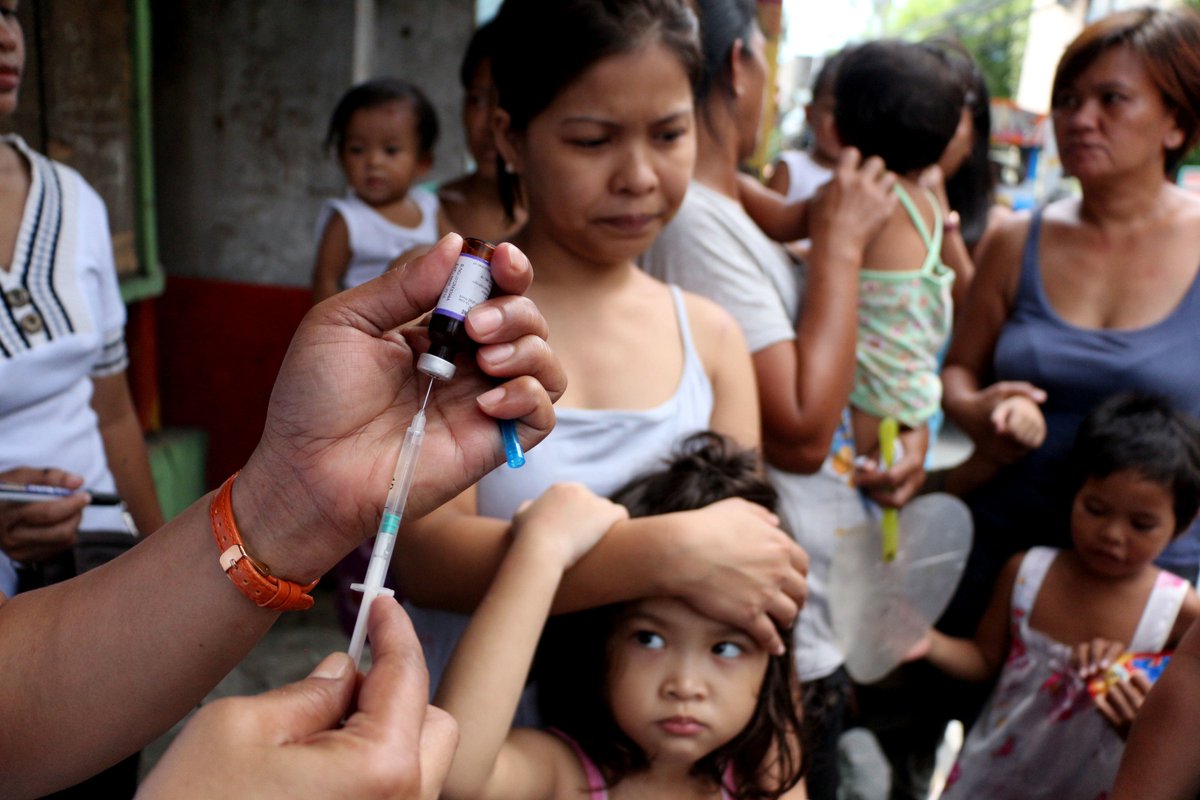 По крайней мере, пять других вакцин против денге находятся в процессе исследований и разработок. Некоторые из этих вакцин доказали свою эффективность. Эти вакцины могут получить одобрение в ближайшие месяцы или годы.
По крайней мере, пять других вакцин против денге находятся в процессе исследований и разработок. Некоторые из этих вакцин доказали свою эффективность. Эти вакцины могут получить одобрение в ближайшие месяцы или годы.
Сколько стоит вакцина против лихорадки денге?
Цены на Dengvaxia® и другие потенциальные вакцины против денге не разглашаются.Как только Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрит вакцину и она поступит на рынок, мы обновим этот раздел.
Нужна ли мне вакцина против лихорадки денге?
Лихорадка денге — потенциально смертельный вирус, который может поразить любого, кто путешествует в регион, где присутствует этот вирус. Некоторые из этих регионов включают:
Что еще я могу сделать для предотвращения лихорадки денге?
Когда вакцина от денге станет доступной, она станет лучшей формой защиты от болезни.А пока медицинские организации, такие как Национальный институт аллергии и инфекционных заболеваний, рекомендуют:
- Используйте репеллент от комаров, содержащий ДЭТА.

- Рассмотрите возможность использования перметрина или другого репеллента, который обеспечит дополнительную защиту одежды.
- Носите рубашки с длинными рукавами, длинные брюки и другую одежду, закрывающую открытые участки кожи.
Планируете ли вы поездку в район, пораженный лихорадкой денге? Хотите узнать больше о том, как защитить себя и свою семью от вируса? Запишитесь на прием к специалисту по медицинским путешествиям по паспорту сегодня, позвонив или сделав онлайн-бронирование.
На этой странице:
Что такое лихорадка денге?
Когда будет доступна вакцина против лихорадки денге?
Сколько стоит вакцина против лихорадки денге?
Нужна ли мне вакцина против лихорадки денге?
Что еще я могу сделать для предотвращения лихорадки денге?
Первая одобренная FDA вакцина для профилактики лихорадки денге в эндемичных регионах
- Для немедленного выпуска:
Español
The U. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США объявило сегодня об одобрении Dengvaxia, первой вакцины, одобренной для профилактики болезни денге, вызываемой всеми серотипами вируса денге (1, 2, 3 и 4), у людей в возрасте от 9 до 16 лет, у которых были лабораторно подтверждены предыдущие лихорадка денге и живущие в эндемичных районах. Денге является эндемическим заболеванием на американских территориях Американского Самоа, Гуама, Пуэрто-Рико и Виргинских островов США.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США объявило сегодня об одобрении Dengvaxia, первой вакцины, одобренной для профилактики болезни денге, вызываемой всеми серотипами вируса денге (1, 2, 3 и 4), у людей в возрасте от 9 до 16 лет, у которых были лабораторно подтверждены предыдущие лихорадка денге и живущие в эндемичных районах. Денге является эндемическим заболеванием на американских территориях Американского Самоа, Гуама, Пуэрто-Рико и Виргинских островов США.
«Болезнь денге является наиболее распространенным вирусным заболеванием, передаваемым комарами, и в последние десятилетия заболеваемость в мире увеличилась», — сказала Анна Абрам, заместитель комиссара FDA по политике, законодательству и международным отношениям.«FDA стремится активно работать с нашими партнерами из Центров США по контролю и профилактике заболеваний, а также с международными партнерами, включая Всемирную организацию здравоохранения, для борьбы с угрозами общественному здоровью, в том числе путем содействия разработке и доступности медицинских продуктов для бороться с возникающими инфекционными заболеваниями. Хотя лекарства от лихорадки денге не существует, сегодняшнее одобрение является важным шагом на пути к снижению воздействия этого вируса на эндемичные регионы Соединенных Штатов.«
Хотя лекарства от лихорадки денге не существует, сегодняшнее одобрение является важным шагом на пути к снижению воздействия этого вируса на эндемичные регионы Соединенных Штатов.«
По оценкам CDC, более одной трети населения мира проживает в районах, подверженных риску заражения вирусом денге, который вызывает лихорадку денге, ведущую причину заболеваний среди людей, живущих в тропиках и субтропиках. Первое заражение вирусом денге обычно не сопровождается симптомами или протекает в легкой форме, которую можно принять за грипп или другую вирусную инфекцию. Последующая инфекция может привести к тяжелой форме денге, включая геморрагическую лихорадку денге (ГЛН), более тяжелую форму заболевания, которая может привести к летальному исходу.Симптомы могут включать боль в животе, постоянную рвоту, кровотечение, спутанность сознания и затрудненное дыхание. Примерно 95 процентов всех тяжелых / госпитализированных случаев денге связаны со второй инфекцией вируса денге. Поскольку не существует специальных препаратов, одобренных для лечения лихорадки денге, помощь ограничивается лечением симптомов.
Согласно данным CDC, ежегодно во всем мире происходит около 400 миллионов случаев инфицирования вирусом денге. Из них примерно 500 000 случаев перерастают в DHF, что является причиной примерно 20 000 смертей, в основном среди детей.Хотя случаи денге редки в континентальной части США, болезнь регулярно обнаруживается в Американском Самоа, Пуэрто-Рико, Гуаме, Виргинских островах США, а также в Латинской Америке, Юго-Восточной Азии и на островах Тихого океана.
«Заражение одним типом вируса денге обычно обеспечивает иммунитет против этого конкретного серотипа, но последующее заражение любым из трех других серотипов вируса увеличивает риск развития тяжелой болезни денге, которая может привести к госпитализации или даже смерти», сказал Питер Маркс, М.D., директор Центра оценки и исследований биологических препаратов FDA. «Поскольку вторая инфекция денге часто бывает более серьезной, чем первая, одобрение этой вакцины FDA поможет защитить людей, ранее инфицированных вирусом денге, от последующего развития болезни денге».
Безопасность и эффективность вакцины были определены в трех рандомизированных плацебо-контролируемых исследованиях с участием примерно 35 000 человек в эндемичных по денге регионах, включая Пуэрто-Рико, Латинскую Америку и Азиатско-Тихоокеанский регион.Было установлено, что вакцина примерно на 76 процентов эффективна в предотвращении симптоматической, лабораторно подтвержденной болезни денге у лиц в возрасте от 9 до 16 лет, у которых ранее была лабораторно подтвержденная болезнь денге. Dengvaxia уже одобрена в 19 странах и Европейском Союзе.
Наиболее частыми побочными эффектами, о которых сообщали те, кто принимал Dengvaxia, были головная боль, боль в мышцах, боль в суставах, усталость, боль в месте инъекции и субфебрильная температура. Частота побочных эффектов была одинаковой у реципиентов Dengvaxia и плацебо и имела тенденцию к снижению после каждой последующей дозы вакцины.
Dengvaxia не одобрен для использования у лиц, которые ранее не были инфицированы каким-либо серотипом вируса денге или для которых эта информация неизвестна.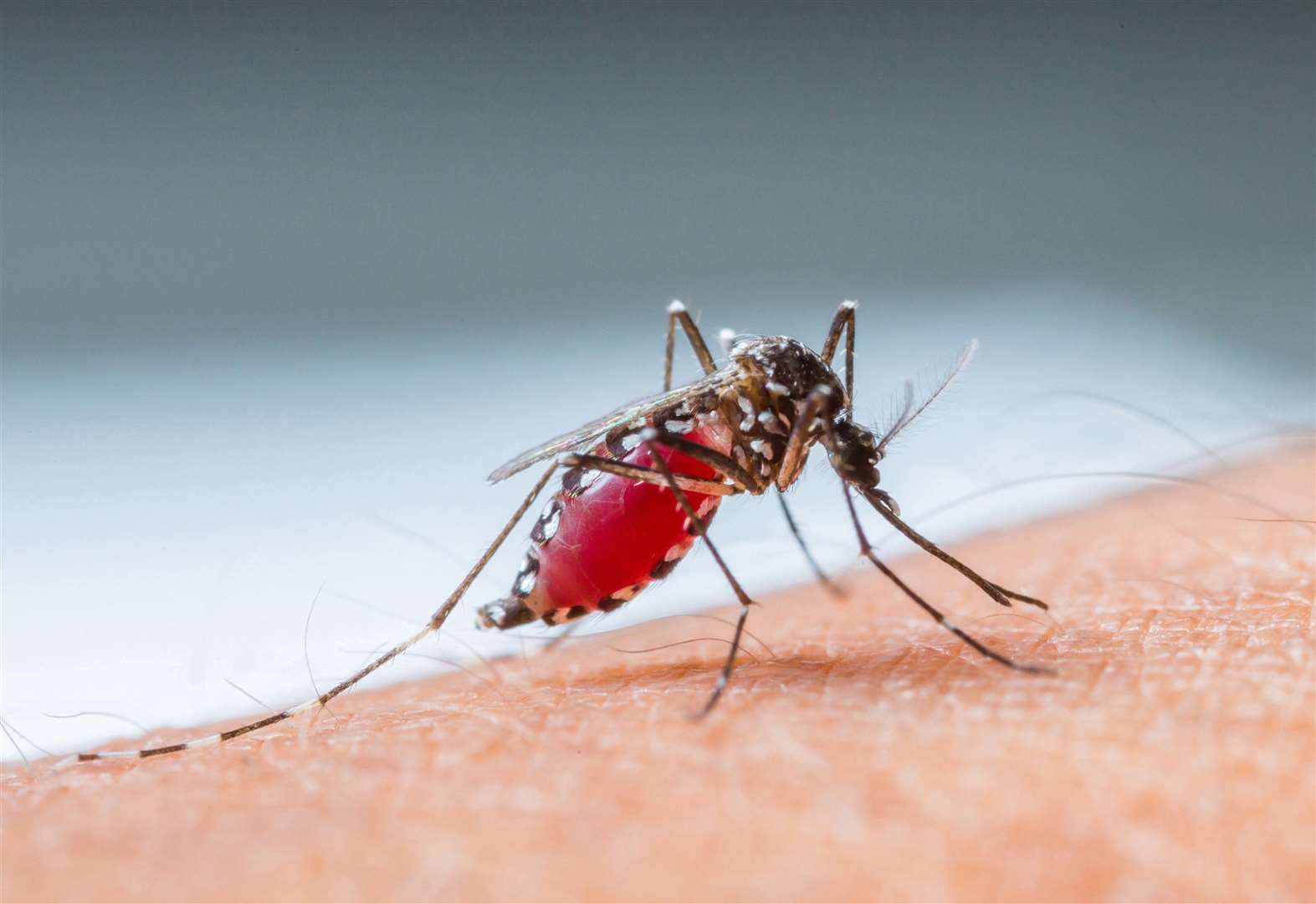 Это связано с тем, что у людей, которые не были инфицированы вирусом денге, Dengvaxia, по-видимому, действует как первая инфекция денге — без фактического заражения человека вирусом денге дикого типа — так что последующая инфекция может привести к тяжелой болезни денге. Специалисты здравоохранения должны обследовать людей на предмет предшествующей инфекции денге, чтобы избежать вакцинации лиц, которые ранее не были инфицированы вирусом денге.Это можно оценить с помощью медицинской документации о предыдущей лабораторно подтвержденной инфекции денге или с помощью серологического тестирования (тесты с использованием образцов крови пациента) до вакцинации.
Это связано с тем, что у людей, которые не были инфицированы вирусом денге, Dengvaxia, по-видимому, действует как первая инфекция денге — без фактического заражения человека вирусом денге дикого типа — так что последующая инфекция может привести к тяжелой болезни денге. Специалисты здравоохранения должны обследовать людей на предмет предшествующей инфекции денге, чтобы избежать вакцинации лиц, которые ранее не были инфицированы вирусом денге.Это можно оценить с помощью медицинской документации о предыдущей лабораторно подтвержденной инфекции денге или с помощью серологического тестирования (тесты с использованием образцов крови пациента) до вакцинации.
Dengvaxia — это живая аттенуированная вакцина, которая вводится в виде трех отдельных инъекций, с начальной дозой, за которой следуют две дополнительные инъекции через шесть и двенадцать месяцев.
FDA предоставило этому заявлению приоритетную проверку и ваучер на приоритетную проверку по тропическим заболеваниям в рамках программы, направленной на поощрение разработки новых лекарств и биопрепаратов для профилактики и лечения определенных тропических болезней. Разрешение было предоставлено Санофи Пастер.
Разрешение было предоставлено Санофи Пастер.
FDA, агентство в составе Министерства здравоохранения и социальных служб США, защищает здоровье населения, обеспечивая безопасность, эффективность и безопасность лекарственных и ветеринарных препаратов, вакцин и других биологических продуктов для использования человеком, а также медицинских устройств. Агентство также отвечает за безопасность и сохранность продуктов питания, косметики, пищевых добавок, продуктов, излучающих электронное излучение, а также за регулирование табачных изделий.
###
Последние разработки и будущие направления в области вакцин против денге
Ther Adv Vaccines. 2014 Янв; 2 (1): 3–9.
иСША Thisyakorn
Кафедра педиатрии, медицинский факультет, Университет Чулалонгкорн, 1873 Rama IV Road, Бангкок 10330, Таиланд
Chule Thisyakorn
Кафедра педиатрии, медицинский факультет, Университет Чулалонгкорн, Бангкок, Таиланд
Usa Thisyakorn, кафедра педиатрии, медицинский факультет, университет Чулалонгкорн, 1873 Rama IV Road, Бангкок 10330, Таиланд;
Автор, ответственный за переписку. Эта статья цитировалась в других статьях в PMC.
Эта статья цитировалась в других статьях в PMC.Abstract
Денге — это болезнь, переносимая комарами, которая в настоящее время представляет собой растущую глобальную проблему здравоохранения. Заболевание вызывается четырьмя близкородственными вирусами — вирусом денге. Специфических терапевтических средств против денге не существует, и профилактика в настоящее время ограничивается мерами борьбы с переносчиками инфекции. Таким образом, разработка эффективной четырехвалентной вакцины против лихорадки денге будет значительным достижением в борьбе с этой болезнью и считается одним из важнейших приоритетов общественного здравоохранения.Хотя лицензированная вакцина против денге еще не доступна, масштабы и интенсивность разработки вакцины против денге резко возросли за последнее десятилетие. Уникальность вирусов денге и спектр заболеваний, вызываемых инфекцией, затруднили разработку вакцины против денге. Несколько вакцин-кандидатов в настоящее время проходят клинические испытания. Кандидат, который в настоящее время находится на наиболее продвинутой стадии клинической разработки, живая аттенуированная четырехвалентная вакцина на основе химерного вируса денге желтой лихорадки, прошел III фазу исследований эффективности.Несколько других живых аттенуированных вакцин, а также субъединичные ДНК и очищенные инактивированные вакцины-кандидаты находятся на ранних стадиях клинической разработки. Дополнительные технологические подходы, такие как вакцины на основе вирусных векторов и вирусоподобных частиц, находятся на стадии доклинических исследований.
Кандидат, который в настоящее время находится на наиболее продвинутой стадии клинической разработки, живая аттенуированная четырехвалентная вакцина на основе химерного вируса денге желтой лихорадки, прошел III фазу исследований эффективности.Несколько других живых аттенуированных вакцин, а также субъединичные ДНК и очищенные инактивированные вакцины-кандидаты находятся на ранних стадиях клинической разработки. Дополнительные технологические подходы, такие как вакцины на основе вирусных векторов и вирусоподобных частиц, находятся на стадии доклинических исследований.
Ключевые слова: инфекция денге, лихорадка денге, вакцины денге, флавивирус , живая аттенуированная четырехвалентная вакцина, разработка
Введение
Инфекция денге, одно из самых разрушительных вирусных заболеваний человека, передаваемых комарами, в настоящее время является a значительная проблема во многих странах.Вирусы, вызывающие денге, являются членами рода Flavivirus в семействе Flaviviridae . Существует четыре близкородственных серотипа: вирусы денге (DENV) 1–4 и по крайней мере четыре генотипа внутри каждого серотипа. Первичная инфекция определенным серотипом денге обеспечивает длительный иммунитет к этому серотипу (гомотипический иммунитет). Иммунитет к другим серотипам денге (гетротипический иммунитет) сохраняется в течение нескольких месяцев, после чего пациенты становятся восприимчивыми к гетеротипической инфекции.Все флавивирусы представляют собой вирусы с положительной цепью РНК с липидной оболочкой. Геном РНК вируса денге составляет около 10,7 т.п.н. и кодирует три структурных белка, а именно белок капсида (C), белок-предшественник мембраны / мембраны (PrM / M) и белок оболочки (E). Помимо структурных белков, существует семь неструктурных белков (NS), которые связаны с вирусной репликацией и патогенезом заболеваний. Кодирование вирусных белков организовано в геноме как C-prM-E-NS1-NS2A-NS2B-NS3-NS4A-NS4B-NS5.Заболевание, вызываемое четырьмя серотипами вируса денге, варьируется от бессимптомной инфекции до недифференцированной лихорадки, лихорадки денге (DF) и тяжелой геморрагической лихорадки денге (DHF).
Существует четыре близкородственных серотипа: вирусы денге (DENV) 1–4 и по крайней мере четыре генотипа внутри каждого серотипа. Первичная инфекция определенным серотипом денге обеспечивает длительный иммунитет к этому серотипу (гомотипический иммунитет). Иммунитет к другим серотипам денге (гетротипический иммунитет) сохраняется в течение нескольких месяцев, после чего пациенты становятся восприимчивыми к гетеротипической инфекции.Все флавивирусы представляют собой вирусы с положительной цепью РНК с липидной оболочкой. Геном РНК вируса денге составляет около 10,7 т.п.н. и кодирует три структурных белка, а именно белок капсида (C), белок-предшественник мембраны / мембраны (PrM / M) и белок оболочки (E). Помимо структурных белков, существует семь неструктурных белков (NS), которые связаны с вирусной репликацией и патогенезом заболеваний. Кодирование вирусных белков организовано в геноме как C-prM-E-NS1-NS2A-NS2B-NS3-NS4A-NS4B-NS5.Заболевание, вызываемое четырьмя серотипами вируса денге, варьируется от бессимптомной инфекции до недифференцированной лихорадки, лихорадки денге (DF) и тяжелой геморрагической лихорадки денге (DHF). DHF характеризуется лихорадкой, кровоточащим диатезом и утечкой плазмы с тенденцией к развитию синдрома потенциально смертельного шока. Инфекция денге с поражением органов в основном поражает центральную нервную систему и печень. Согласованные гематологические данные включают васкулопатию, коагулопатию и тромбоцитопению. Лабораторная диагностика включает выделение вируса, серологию и обнаружение рибонуклеиновой кислоты денге.Успешное лечение, которое в основном является поддерживающим, зависит от раннего распознавания болезни и тщательного наблюдения за шоком. Пересмотренная классификация лихорадки денге для медицинских вмешательств на основе степени тяжести была разработана и утверждена во многих странах.
DHF характеризуется лихорадкой, кровоточащим диатезом и утечкой плазмы с тенденцией к развитию синдрома потенциально смертельного шока. Инфекция денге с поражением органов в основном поражает центральную нервную систему и печень. Согласованные гематологические данные включают васкулопатию, коагулопатию и тромбоцитопению. Лабораторная диагностика включает выделение вируса, серологию и обнаружение рибонуклеиновой кислоты денге.Успешное лечение, которое в основном является поддерживающим, зависит от раннего распознавания болезни и тщательного наблюдения за шоком. Пересмотренная классификация лихорадки денге для медицинских вмешательств на основе степени тяжести была разработана и утверждена во многих странах.
Профилактика зависит в первую очередь от борьбы с комарами-переносчиками, которые достигли лишь ограниченного успеха в сокращении передачи лихорадки денге. Первичный переносчик, адаптированный для городских условий Aedes aegypti , получил широкое распространение в тропических и субтропических широтах. Он распространился по всему миру с появлением увеличения путешествий и торговли за последние 50 лет. Вторичный вектор, Aedes albopictus , за последние годы значительно расширился. Причинами продолжения передачи являются рост населения, быстрая урбанизация, изменение окружающей среды, изменение климата, современный транспорт, неадекватное хранение воды, отсутствие политической приверженности и отсутствие межсекторального сотрудничества. Патогенез DHF до конца не изучен. Одна гипотеза относительно вирулентности вируса обсуждалась с гипотезой усиления иммунитета.Хотя тяжесть заболевания денге была связана с доказательствами генетических различий в штаммах денге, вирулентность вируса было трудно измерить из-за отсутствия моделей in vivo, и in vitro, . Денге представляет собой серьезную и растущую угрозу общественному здоровью в Юго-Восточной Азии, на которую приходится почти 75% нынешнего глобального бремени лихорадки денге. Конкретные противовирусные препараты для лечения лихорадки денге отсутствуют, а профилактика с использованием средств борьбы с переносчиками имеет некоторый, но ограниченный успех.
Он распространился по всему миру с появлением увеличения путешествий и торговли за последние 50 лет. Вторичный вектор, Aedes albopictus , за последние годы значительно расширился. Причинами продолжения передачи являются рост населения, быстрая урбанизация, изменение окружающей среды, изменение климата, современный транспорт, неадекватное хранение воды, отсутствие политической приверженности и отсутствие межсекторального сотрудничества. Патогенез DHF до конца не изучен. Одна гипотеза относительно вирулентности вируса обсуждалась с гипотезой усиления иммунитета.Хотя тяжесть заболевания денге была связана с доказательствами генетических различий в штаммах денге, вирулентность вируса было трудно измерить из-за отсутствия моделей in vivo, и in vitro, . Денге представляет собой серьезную и растущую угрозу общественному здоровью в Юго-Восточной Азии, на которую приходится почти 75% нынешнего глобального бремени лихорадки денге. Конкретные противовирусные препараты для лечения лихорадки денге отсутствуют, а профилактика с использованием средств борьбы с переносчиками имеет некоторый, но ограниченный успех. Вакцины от денге находятся в стадии клинической разработки, а ведущий кандидат в настоящее время проходит III фазу клинических испытаний. Вакцина против денге может быть основным средством эффективной борьбы с болезнями денге [Hemungkorn et al. 2007; Wan et al. 2013].
Вакцины от денге находятся в стадии клинической разработки, а ведущий кандидат в настоящее время проходит III фазу клинических испытаний. Вакцина против денге может быть основным средством эффективной борьбы с болезнями денге [Hemungkorn et al. 2007; Wan et al. 2013].
Современные разработки вакцин против денге
Первые вакцины против денге были оценены в 1929 году [Blac and Caminopetros, 1930; Simmons et al. 1931]. Разработка безопасных и эффективных вакцин против денге сталкивается с множеством проблем.Было показано, что заражение одним из четырех серотипов вируса денге обеспечивает длительную защиту от гомотипической повторной инфекции, но только временную защиту от вторичной гетеротипической инфекции. Более того, вторичная гетеротипическая инфекция связана с повышенным риском тяжелого заболевания. Это и другие наблюдения предполагают наличие иммунопатологического компонента в патогенезе денге, который называется усилением иммунитета при заболевании. Из-за этих специфических для денге сложностей при разработке вакцины основное внимание уделяется созданию четырехвалентной вакцины, нацеленной на обеспечение долгосрочной защиты от всех серотипов вируса.Теоретически четырехвалентный иммунный ответ защитит от лихорадочного заболевания денге, а также снизит или устранит риск антителозависимого усиления, которое считается одним из механизмов, предрасполагающих людей к тяжелой денге. Дополнительные проблемы возникают из-за отсутствия адекватной модели болезни животных и связанной с этим неопределенности в отношении коррелятов защиты. Несмотря на эти проблемы, в последние годы в разработке вакцин был достигнут значительный прогресс, и текущая линейка вакцин против лихорадки денге является продвинутой, разнообразной и в целом многообещающей.
Из-за этих специфических для денге сложностей при разработке вакцины основное внимание уделяется созданию четырехвалентной вакцины, нацеленной на обеспечение долгосрочной защиты от всех серотипов вируса.Теоретически четырехвалентный иммунный ответ защитит от лихорадочного заболевания денге, а также снизит или устранит риск антителозависимого усиления, которое считается одним из механизмов, предрасполагающих людей к тяжелой денге. Дополнительные проблемы возникают из-за отсутствия адекватной модели болезни животных и связанной с этим неопределенности в отношении коррелятов защиты. Несмотря на эти проблемы, в последние годы в разработке вакцин был достигнут значительный прогресс, и текущая линейка вакцин против лихорадки денге является продвинутой, разнообразной и в целом многообещающей.
Тетравалентная вакцина против денге должна быть разработана без полного понимания патогенеза тяжелой болезни денге или адекватной модели болезни животных [Prommalikit et al. 2004; Проммаликит, Тисьякорн, 2013]. В последнее десятилетие усилия по разработке вакцин против денге резко возросли из-за повышения осведомленности о пандемии денге и разработки новых молекулярных методов.
В последнее десятилетие усилия по разработке вакцин против денге резко возросли из-за повышения осведомленности о пандемии денге и разработки новых молекулярных методов.
Существует несколько важных вопросов безопасности вакцин против денге.Основным среди этих опасений является теоретический риск обострения болезни после вакцинации против денге. Основанием для четырехвалентной вакцины является предполагаемая потребность в индукции иммунного ответа первичного типа на все четыре вируса денге одновременно. Прогнозируется, что одновременная выработка иммунного ответа, специфичного для каждого из четырех вирусов денге, минимизирует риск усиления болезни после естественного инфицирования. Однако антитело-зависимое усиление может происходить с нейтрализующими антителами в субнейтрализующих концентрациях, поэтому вакцина, которая индуцирует защиту в течение некоторого периода времени, может позже повысить риск усиленного заболевания.Это особенно важно для вакцин, индуцирующих низкие уровни нейтрализующих антител [Burton et al. 2000], но может произойти с любой вакциной, если дать ей достаточно времени. Для адекватной оценки этого риска и риска неполной иммунизации и снижения титров антител в планы клинической разработки вакцины против денге должны входить добровольцы, примированные флавивирусом и не имевшие отношения к флавивирусу, а также достаточно долгосрочное наблюдение, чтобы сделать статистически обоснованные выводы относительно безопасности вакцинации против денге. в эндемичных по флавивирусу районах.Другие проблемы безопасности живых аттенуированных вирусных вакцин включают побочные агенты, полученные из клеточных культур, распространение вируса вакцины резидентными комарами-переносчиками среди населения, нейровирулентность вакцинного вируса и эффекты введения вакцины хозяевам с ослабленным иммунитетом. Хотя эти проблемы безопасности теоретически возможны, они крайне маловероятны с учетом имеющихся данных [Edelman and Hombach, 2008].
2000], но может произойти с любой вакциной, если дать ей достаточно времени. Для адекватной оценки этого риска и риска неполной иммунизации и снижения титров антител в планы клинической разработки вакцины против денге должны входить добровольцы, примированные флавивирусом и не имевшие отношения к флавивирусу, а также достаточно долгосрочное наблюдение, чтобы сделать статистически обоснованные выводы относительно безопасности вакцинации против денге. в эндемичных по флавивирусу районах.Другие проблемы безопасности живых аттенуированных вирусных вакцин включают побочные агенты, полученные из клеточных культур, распространение вируса вакцины резидентными комарами-переносчиками среди населения, нейровирулентность вакцинного вируса и эффекты введения вакцины хозяевам с ослабленным иммунитетом. Хотя эти проблемы безопасности теоретически возможны, они крайне маловероятны с учетом имеющихся данных [Edelman and Hombach, 2008].
В настоящее время несколько вакцин против лихорадки денге прошли клинические испытания на людях, и один кандидат сейчас проходит фазу III клинических испытаний. Здесь обсуждаются различные подходы к разработке вакцины против денге.
Здесь обсуждаются различные подходы к разработке вакцины против денге.
Живой аттенуированный вирус
Первые крупные усилия по разработке живой аттенуированной вакцины против денге были предприняты в Гавайском университете с использованием традиционного метода последовательного переноса вируса в нечеловеческом хозяине, а затем переданы в Университет Махидол в Бангкоке, Таиланд для дальнейшего прохождения и переноса. разработка и тестирование вакцин-кандидатов [Bhamarapravati and Sutee, 2000; Halstead and Marchette, 2003]. Вакцина-кандидат использовалась для фаз I и II клинических испытаний у взрослых и детей Таиланда.Не у всех добровольцев произошла сероконверсия ко всем четырем серотипам денге, а некоторые показали неприемлемую реактогенность, поэтому дальнейшие клинические испытания были прекращены [Sabchareon et al. 2002, 2004; Sanchez et al. 2006]. Хотя разработка этой вакцины-кандидата не увенчалась успехом, эта инициатива была ответственна за последующий прогресс, достигнутый в разработке живой аттенуированной четырехвалентной вакцины против денге [Всемирная организация здравоохранения, 2010].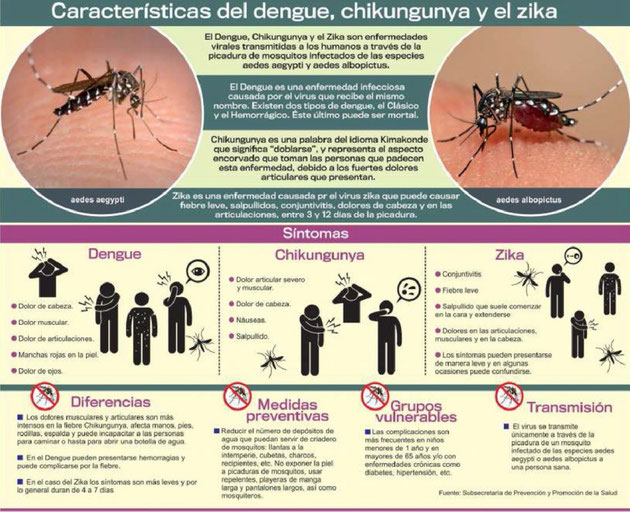
Вторая вакцина против лихорадки денге после пассирования тканевой культурой была разработана в Исследовательском институте армии Уолтера Рида (WRAIR).Первоначальный состав четырехвалентной вакцины против денге, произведенный WRAIR, также показал проблемы несбалансированной иммуногенности и реактогенности [Sun et al. 2003].
Новые составы кажутся безопасными и иммуногенными в исследовании фазы II, однако защитная эффективность требует дальнейшей оценки [Thomas et al. 2013]. Дальнейшие испытания откладываются из-за сложности производства и определения оптимальной дозы и схемы вакцины [Balas et al. 2011; Холстед, Томас, 2013].
Национальные институты здравоохранения США открыли новую эру исследований вакцины против денге с технологией прямого мутагенеза. Геномы лихорадки денге были легко изменены генетически, что привело к появлению ослабленных вариантов, которые были протестированы на взрослых в США, не инфицированных флавивирусами. Национальные институты здравоохранения предоставили несколько организаций-кандидатов вакцины лицензии для дальнейшего тестирования.
Национальные институты здравоохранения предоставили несколько организаций-кандидатов вакцины лицензии для дальнейшего тестирования.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США также создало молекулярно аттенуированную четырехвалентную вакцину против денге, которая была протестирована на нечеловеческих приматах [Lai et al. 1991; Polo et al. 1997; Холстед, Томас, 2013].
Оба метода обеспечивают альтернативный подход к созданию живой аттенуированной четырехвалентной вакцины против денге [Halstead and Thomas, 2013].
Химерный вирус
Центры США по контролю и профилактике заболеваний (CDC) разработали четырехвалентную химерную вакцину против денге путем вставки генов PRM и E DENV-1, -3 и -4 в кДНК, полученную из успешно аттенуированного компонента DEN-2 живая аттенуированная вакцина против вируса денге (DEN-2, 16681 PDK-53) из Университета Махидол — Санофи Пастер.
Кандидат в четырехвалентную вакцину химер денге и денге был затем составлен и лицензирован Inviragen, Inc. и Takeda, соответственно, и прошел клинические испытания [Lai et al. 1991; Polo et al. 1997; Холстед и Томас, 2013; Хуанг и др. 2013].
и Takeda, соответственно, и прошел клинические испытания [Lai et al. 1991; Polo et al. 1997; Холстед и Томас, 2013; Хуанг и др. 2013].
Другой подход был использован для вставки структурных генов денге в инфекционный каркас кДНК хорошо зарекомендовавшего себя вакцинного штамма вируса желтой лихорадки 17D. Это было начато в медицинских школах Вашингтонского и Сент-Луисского университетов.Эти химеры желтой лихорадки коммерчески разрабатываются Acambis, Inc. [Rice et al. 1989; Guirakhoo et al. 2000, 2004] и лицензию на производство предоставила Санофи Пастер. Клетки Vero служат субстратом для производства вакцинного вируса. Результаты фазы IIb Санофи Пастер, ведущей кандидатной вакцины против денге, впервые показывают, что безопасная и эффективная вакцина против денге возможна. Эта вакцина-кандидат была иммуногенной для всех четырех серотипов и могла защищать от серотипов 1, 3 и 4 вируса денге из четырех серотипов [Sabchareon et al. 2012]. Вакцина-кандидат в настоящее время перешла к фазе III исследований эффективности. В отсутствие корреляции защиты требуются крупные испытания эффективности, чтобы доказать эффективность против лихорадки денге в полевых условиях и создать надежную базу данных по безопасности [Wallace et al. 2013].
2012]. Вакцина-кандидат в настоящее время перешла к фазе III исследований эффективности. В отсутствие корреляции защиты требуются крупные испытания эффективности, чтобы доказать эффективность против лихорадки денге в полевых условиях и создать надежную базу данных по безопасности [Wallace et al. 2013].
Живые аттенуированные и живые химерные вакцины против лихорадки денге при прививке детям или взрослым с иммунитетом к денге не приводили к усилению заболевания, вызываемого вакцинным вирусом [Guy et al. 2011].Оценки риска передачи переносчиков инфекции реципиентами вакцины также проводились многочисленными разработчиками вакцины против денге. Результаты опубликованных исследований указывают на очень низкую вероятность того, что вакцина может передавать вирусы денге вакцинного происхождения комару [Sardelis et al. 2000; Johnson et al. 2002, 2004; Higgs et al. 2006; McGee et al. 2008].
Стратегии на основе молекулярных клонов для четырехвалентной вакцины против денге имеют важные преимущества по сравнению с традиционной аттенуацией в культуре клеток. К ним относятся снижение риска случайных агентов, которые также снизят затраты на обеспечение качества продукции, и молекулярное объяснение ослабления.
К ним относятся снижение риска случайных агентов, которые также снизят затраты на обеспечение качества продукции, и молекулярное объяснение ослабления.
Интерференция, наблюдаемая при прививке смеси четырех вирусов денге чувствительным добровольцам, также должна быть изучена на генетически модифицированных вакцинных вирусах [Vaughn et al. 2008].
Инактивированный вирус
Инактивированные цельновирусные вакцины имеют два преимущества, поскольку они не могут вернуться к более патогенному фенотипу и вряд ли будут мешать друг другу в комбинации.Более того, индукция клеточно-опосредованных и гуморальных иммунных ответов была продемонстрирована с помощью инактивированных флавивирусных вакцин [Aihara et al. 2000].
Однако инактивированные вакцины экспрессируют только ту часть вирусного генома, которая кодирует структурные белки. В контексте иммунитета и иммунопатологии денге повышение уровня антител, которые могут не обеспечивать полную защиту, может привести к прорывным инфекциям или усилению инфекций, вызванных вирусами денге дикого типа, и потребностью в адъювантах для повышения иммуногенности. Два адъюванта AS03 и AS04 были включены в вакцины, лицензированные для использования на людях, и исследуются WRAIR / GSK / Oswald Cruz Foundation по борьбе с вакциной против денге [Garcon et al. 2011; Morel et al. 2011].
Два адъюванта AS03 и AS04 были включены в вакцины, лицензированные для использования на людях, и исследуются WRAIR / GSK / Oswald Cruz Foundation по борьбе с вакциной против денге [Garcon et al. 2011; Morel et al. 2011].
Субъединичные вакцины
Подходы с рекомбинацией субъединиц предлагают преимущества, включая ожидаемую минимальную реактогенность и отсутствие побочных агентов. Однако неполный посттрансляционный процессинг белков может приводить к белкам, которые отличаются от нативных белков, и к ответам антител [Smucny et al. 1995]. Продукция в клетках млекопитающих может уменьшить некоторые из этих проблем [Konishi and Fujii, 2002]. Фаза I исследования по оценке безопасности и переносимости кандидата DEN-1 у здоровых взрослых в США была завершена, и ожидается публикация результатов [National Institutes of Health, 2013].
ДНК-вакцины
ДНК-вакцины против денге предлагают возможный метод повышения защитного иммунитета, обходя проблему интерференции, наблюдаемую при использовании поливалентных живых вирусных вакцин. ДНК-вакцины состоят из плазмиды или плазмид, содержащих гены денге.Вакцина с тетравалентной ДНК, привитая мышам и обезьянам, успешно вырабатывала нейтрализующие антитела. Обезьяны сопротивлялись воздействию DEN-1, но не DEN-2 [Whalen, 1996; Apt et al. 2006; Равипракаш и др. 2006].
ДНК-вакцины состоят из плазмиды или плазмид, содержащих гены денге.Вакцина с тетравалентной ДНК, привитая мышам и обезьянам, успешно вырабатывала нейтрализующие антитела. Обезьяны сопротивлялись воздействию DEN-1, но не DEN-2 [Whalen, 1996; Apt et al. 2006; Равипракаш и др. 2006].
ДНК-вакцина DENV-1 была оценена на флавивирус-отрицательных добровольцах серией из трех доз в день 0, а также через 1 и 5 месяцев. Ни у одного из добровольцев, получавших низкую дозу, и у половины добровольцев, получавших высокую дозу, не развились нейтрализующие антитела [Beckett et al. 2011]. Совсем недавно защита была достигнута на модели макаки-резуса путем усиления вакцинации четырехвалентной ДНК четырехвалентной живой аттенуированной вакциной против денге [Simmons et al. 2010].
ДНК-подход также несет в себе уникальный риск, который включает теоретический риск интеграции нуклеиновых кислот в хромосомную ДНК хозяина с целью потенциально инактивировать гены-супрессоры опухоли или активировать онкогены [Klinman et al. 1997; Jechlinger, 2006]. Этот риск, по-видимому, намного ниже частоты спонтанных мутаций для клеток млекопитающих [Nichols et al. 1995; Martin et al. 1999]. Однако, если мутация из-за интеграции ДНК является частью феномена множественных ударов, ведущего к канцерогенезу, может пройти много лет, прежде чем эта проблема станет очевидной. Другая проблема заключается в том, что чужеродная ДНК может индуцировать антитела против ДНК, что приводит к аутоиммунным заболеваниям, таким как системная красная волчанка. Однако исследования на мышах, склонных к волчанке, нормальных мышах, кроликах и людях на сегодняшний день не подтвердили эту озабоченность [Mor et al. 1997, Parker et al. 1999].
1997; Jechlinger, 2006]. Этот риск, по-видимому, намного ниже частоты спонтанных мутаций для клеток млекопитающих [Nichols et al. 1995; Martin et al. 1999]. Однако, если мутация из-за интеграции ДНК является частью феномена множественных ударов, ведущего к канцерогенезу, может пройти много лет, прежде чем эта проблема станет очевидной. Другая проблема заключается в том, что чужеродная ДНК может индуцировать антитела против ДНК, что приводит к аутоиммунным заболеваниям, таким как системная красная волчанка. Однако исследования на мышах, склонных к волчанке, нормальных мышах, кроликах и людях на сегодняшний день не подтвердили эту озабоченность [Mor et al. 1997, Parker et al. 1999].
Векторные вакцины
Было продемонстрировано, что рекомбинантные поксвирусы и аденовирусы, экспрессирующие чужеродные белки, вызывают у людей сильные гуморальные и клеточные ответы против различных патогенов. Некоторые живые вирусные векторы, такие как аденовирус, альфавирус и вирус осповакцины, разработаны для непосредственного введения хозяину и были сконструированы для экспрессии белка DENV E для дальнейшей оценки в качестве кандидатов на вакцину против денге [Halstead and Thomas, 2013; Wan et al. 2013].
2013].
Более того, рекомбинация белков Е, экспрессируемых из клеток дрожжей и насекомых, и вакцины против денге на основе вирусоподобных частиц, были другими подходами и в рамках доклинических исследований [Arora et al. 2013; Mani et al. 2013; Wan et al. 2013].
Перспективы развития вакцин против денге
Хотя лицензированной вакцины против денге не существует, растущие знания о разработке вакцины против денге позволяют лучше понять, как улучшить дизайн вакцины.
Несколько многообещающих кандидатов на вакцину против денге находятся в стадии доклинических и клинических разработок, и одна из них перешла в фазу III тестирования. Необходимы дополнительные исследования корреляции защиты от DENV-2 в испытании фазы IIb Санофи Пастер, несмотря на сбалансированный нейтрализующий ответ антител на вакцинацию. Экономические силы и технологический прогресс должны вскоре вывести на рынок одну или несколько вакцин против лихорадки денге.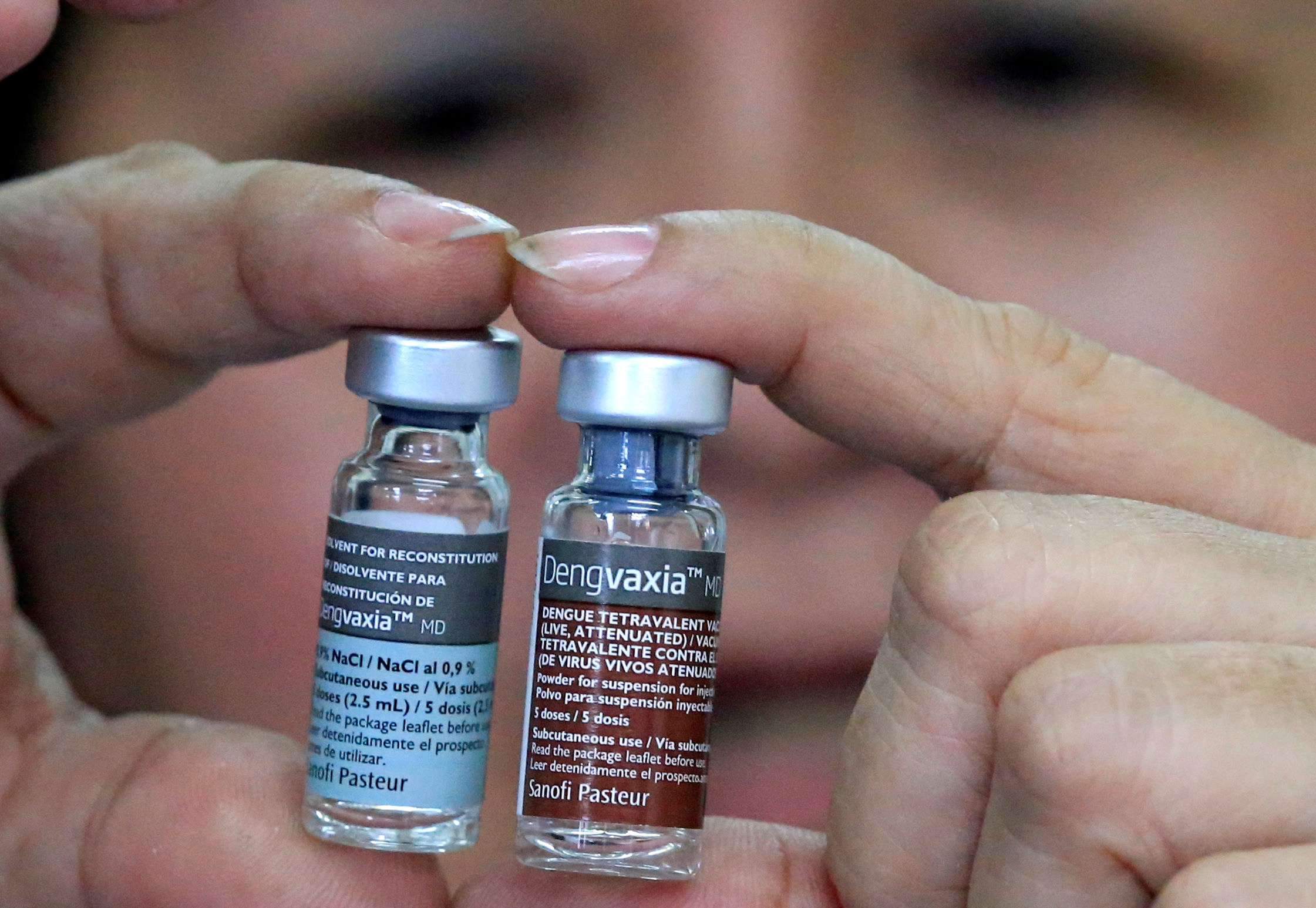 Сообществу вакцин остается разработать и реализовать планы стратегического использования вакцин против лихорадки денге путем разработки научно-обоснованной политики для нацеливания на группы высокого риска и снижения передачи вируса [Wan et al. 2013].
Сообществу вакцин остается разработать и реализовать планы стратегического использования вакцин против лихорадки денге путем разработки научно-обоснованной политики для нацеливания на группы высокого риска и снижения передачи вируса [Wan et al. 2013].
Необходимо обеспечить наличие и поддержание адекватного эпиднадзора для выявления безопасности и эффективности вакцины против денге в постлицензионный период. Ранняя подготовка и понимание истинного бремени болезни будут иметь важное значение для успешного внедрения вакцины [Всемирная организация здравоохранения, 2011], и с учетом этого Руководящий комитет по пропаганде вакцинации против денге (ADVASC) государств-членов АСЕАН созвал региональный семинар для обзора текущее состояние эпиднадзора и диагностики денге в регионе АСЕАН.
ADVASC рекомендовал научно обоснованный подход к усилению и гармонизации ключевых характеристик эпиднадзора за денге, включая классификацию случаев, сбор данных, анализ данных и лабораторные испытания. Для усиления политики вакцинации потребуются дальнейшие инвестиции в существующие системы здравоохранения, при этом особое внимание уделяется рекомендациям по исследованиям и пропаганде [Thisyakorn, 2012; Thisyakorn и др. . 2013].
Для усиления политики вакцинации потребуются дальнейшие инвестиции в существующие системы здравоохранения, при этом особое внимание уделяется рекомендациям по исследованиям и пропаганде [Thisyakorn, 2012; Thisyakorn и др. . 2013].
Заключение
Вирус денге является возбудителем широкого спектра клинических проявлений, от легкого острого фебрильного заболевания до классических DF и DHF.DHF вызывается потенциально смертельными формами вирусной инфекции денге, которая стала трудноразрешимой глобальной проблемой здравоохранения.
Борьба с переносчиками принесла лишь ограниченный успех в сокращении передачи денге, и в настоящее время нет лицензированных противовирусных препаратов для лечения денге. Самый эффективный способ борьбы с болезнями денге в будущем будет включать использование безопасной и эффективной вакцины. Денге — уникальное и сложное заболевание; Разработка вакцины против денге оказалась столь же сложной задачей.Хотя лицензированной вакцины против денге еще нет, несколько вакцин-кандидатов находятся в стадии разработки, включая живые аттенуированные вирусные вакцины, живые химерные вирусные вакцины, инактивированные вирусные вакцины и живые рекомбинантные ДНК и субъединичные вакцины.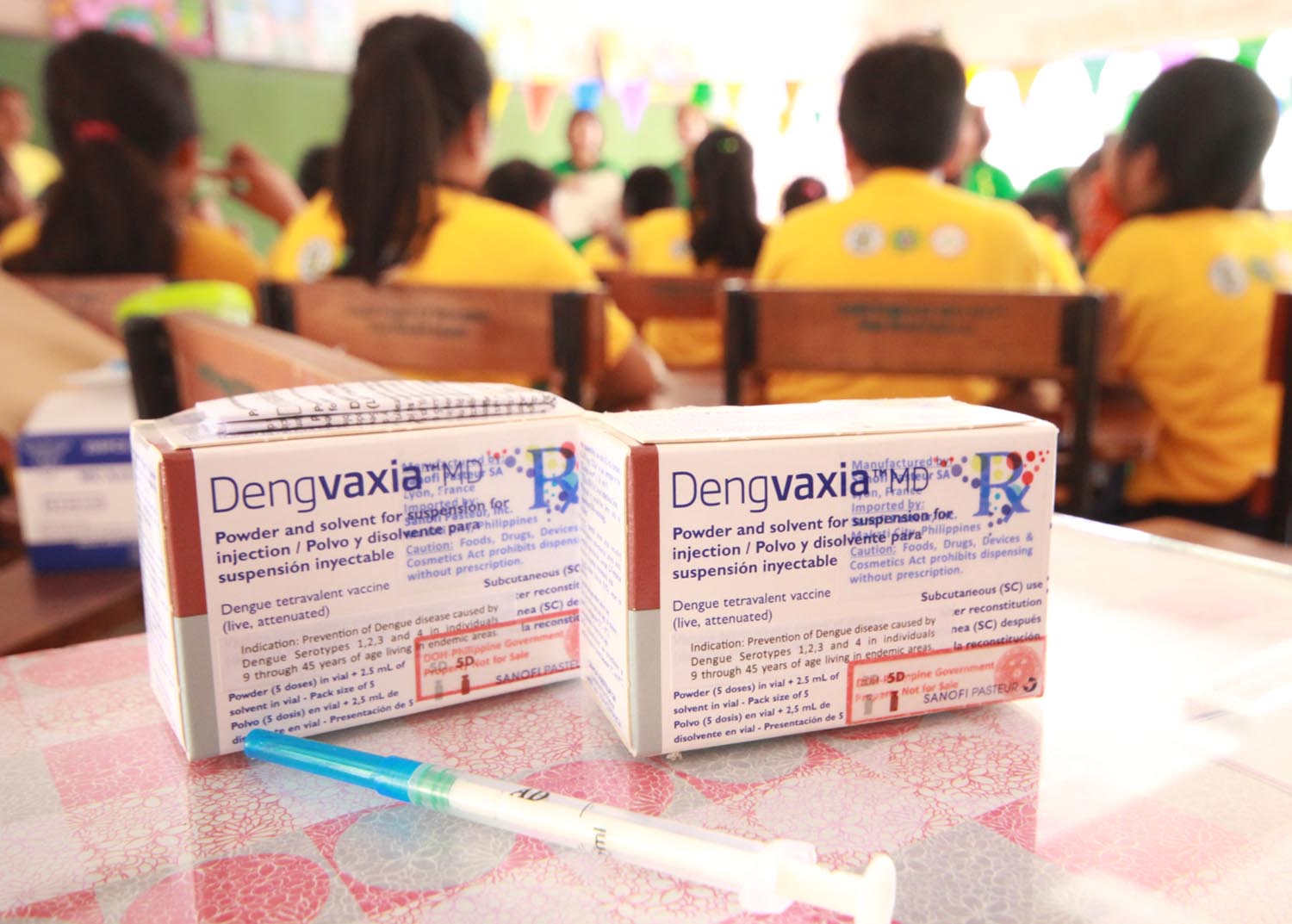 Вакцина с живым химерным вирусом проходит III фазу клинических испытаний. Другие вакцины-кандидаты оценивались на доклинических моделях на животных или готовятся к клиническим испытаниям.
Вакцина с живым химерным вирусом проходит III фазу клинических испытаний. Другие вакцины-кандидаты оценивались на доклинических моделях на животных или готовятся к клиническим испытаниям.
Сноски
Финансирование: Это исследование не получало специального гранта от какого-либо финансирующего агентства в государственном, коммерческом или некоммерческом секторах.
Заявление о конфликте интересов: Авторы заявляют об отсутствии конфликта интересов при подготовке этой статьи.
Информация для авторов
Usa Thisyakorn, Департамент педиатрии, Медицинский факультет, Университет Чулалонгкорн, 1873 Rama IV Road, Бангкок 10330, Таиланд.
Чуле Тисьякорн, кафедра педиатрии, медицинский факультет, Университет Чулалонгкорн, Бангкок, Таиланд.
Ссылки
- Айхара Х., Такасаки Т., Toyosaki-Maeda T., Suzuki R., Okuno Y., Kurane I. (2000) Активация Т-клеток и индукция антител и Т-клеток памяти путем иммунизации инактивированной вакциной против японского энцефалита.
 Вирусный Иммунол
13: 179–186 [PubMed] [Google Scholar]
Вирусный Иммунол
13: 179–186 [PubMed] [Google Scholar] - Апт Д., Равипракаш К., Бринкман А., Семенов А., Ян С., Скиннер С. и др. (2006) Ответ тетравалентных нейтрализующих антител против четырех серотипов денге одним химерным антигеном оболочки денге. Вакцина 24: 335–344 [PubMed] [Google Scholar]
- Арора У., Tyagi P., Swaminathan S., Khanna N. (2013) Вирусоподобные частицы, демонстрирующие домен III оболочки вируса денге 2 типа, вызывают у мышей вирус-специфический ответ антител. Вакцина 31: 873–878 [PubMed] [Google Scholar]
- Balas C., Kennel A., Deauvieau F., Sodoyer R., Arnaud-Barbe N., Lang J., et al. (2011) Различные врожденные сигнатуры, индуцированные в человеческих дендритных клетках, происходящих из моноцитов, вирусом денге 3 дикого типа, аттенуированным, но реактогенным вакцинным вирусом денге 3 или аттенуированными нереактогенными штаммами вакцинного вируса денге 1–4.J заразить Дис 203: 103–108 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Беккет К.
 , Тьяден Дж., Берджесс Т., Данко Дж., Тамминга К., Симмонс М. и др. (2011) Оценка прототипа ДНК-вакцины против лихорадки денге-1 в клинических испытаниях фазы 1. Вакцина
29: 960–968 [PubMed] [Google Scholar]
, Тьяден Дж., Берджесс Т., Данко Дж., Тамминга К., Симмонс М. и др. (2011) Оценка прототипа ДНК-вакцины против лихорадки денге-1 в клинических испытаниях фазы 1. Вакцина
29: 960–968 [PubMed] [Google Scholar] - Бхамараправати Н., Сути Ю. (2000) Живая аттенуированная четырехвалентная вакцина против денге. Вакцина 18 (Приложение 2): 44–47 [PubMed] [Google Scholar]
- Blac G., Caminopetros J. (1930) Recherches Experimentales sur la dengue.Энн Инст Пастер Пэрис 44: 367–436 [Google Scholar]
- Бертон Д., Уильямсон Р., Паррен П. (2000) Антитело и вирус: связывание и нейтрализация. Вирусология 270: 1–3 [PubMed] [Google Scholar]
- Эдельман Р., Хомбах Дж. (2008) «Рекомендации по клинической оценке вакцин против денге в эндемичных районах»: резюме технической консультации Всемирной организации здравоохранения. Вакцина 26: 4113–4119 [PubMed] [Google Scholar]
- Гарсон Н., Веттендорф М., Ван Мехелен М. (2011) Роль AS04 в вакцине против вируса папилломы человека: механизм действия и клинический профиль.
 Мнение эксперта Biol Ther
11: 667–677 [PubMed] [Google Scholar]
Мнение эксперта Biol Ther
11: 667–677 [PubMed] [Google Scholar] - Гуираку Ф., Велтцин Р., Чемберс Т., Чжан З., Сойке К., Раттерри М. и др. (2000) Рекомбинантный химерный вирус желтой лихорадки денге 2 типа является иммуногенным и защитным для нечеловеческих приматов. J Virol 74: 5477–5485 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Guirakhoo F., Zhang Z., Myers G., Levenbook I., Draper K., et al. (2004) Безопасность и эффективность композиций четырехвалентной вакцины химерного вируса желтой лихорадки и вируса денге для нечеловеческих приматов.J Virol 78: 4761–4775 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гай Б., Баррере Б., Малиновски К., Сэвилл М., Тейсу Р., Ланг Дж. (2011) От исследования к фазе III: доклиническая, промышленная и клиническая разработка четырехвалентной вакцины против денге Санофи Пастер. Вакцина 29: 7229–7241 [PubMed] [Google Scholar]
- Холстед С., Маркетт Н. (2003) Биологические свойства вирусов денге после последовательного пассажа в первичных клетках почек собаки: исследования в Гавайском университете.
 Am J Trop Med Гигиена
69: 5–11 [PubMed] [Google Scholar]
Am J Trop Med Гигиена
69: 5–11 [PubMed] [Google Scholar] - Холстед С., Томас С. (2013) Вакцины против денге. В: Плоткин С., Оренштейн В., Оффит П. (ред.), Вакцины против денге. Elsevier: China, pp. 1042–1051 [Google Scholar]
- Хемунгкорн М., Тисьякорн У., Тисьякорн С. (2007) Инфекция денге: растущая глобальная угроза здоровью. Biosci Trends 1: 90–96 [PubMed] [Google Scholar]
- Хиггс С., Ванландингем Д., Клинглер К., Макелрой К., МакГи К., Харрингтон Л. и др. (2006) Характеристики роста вакцинных вирусов ChimeriVax-Den у Aedes aegypti и Aedes albopictus из Таиланда.Am J Trop Med Hyg 75: 986–993 [PubMed] [Google Scholar]
- Хуанг К., Кинни Р., Ливенгуд Дж., Боллинг Б., Аргуэлло Дж., Луи Б. и др. (2013) Генетическая и фенотипическая характеристика семян для производства четырехвалентной вакцины против денге (Denvax). PLoS Negl Trop Dis 7: e2243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Jechlinger W. (2006) Оптимизация и доставка плазмидной ДНК для вакцинации.
 Экспертные ревакцины
5: 803–825 [PubMed] [Google Scholar]
Экспертные ревакцины
5: 803–825 [PubMed] [Google Scholar] - Джонсон Б., Chambers T., Crabtree M., Bhatt T., Guirakhoo F., Monath T. и др. (2002) Характеристики роста вакцинного вируса ChimeriVax-Den2 у комаров Aedes aegypti и Aedes albopictus. Am J Trop Med Hyg 67: 260–265 [PubMed] [Google Scholar]
- Johnson B., Chambers T., Crabtree M., Guirakhoo F., Monath T., Miller B. (2004) Анализ кинетики репликации смеси четырехвалентных вирусов ChimeriVax-Den 1, 2, 3, 4 в Aedes aegypti с помощью полимеразная цепная реакция обратной транскриптазы в реальном времени.Am J Trop Med Hyg 70: 89–97 [PubMed] [Google Scholar]
- Клинман Д., Такено М., Ичино М., Гу М., Ямщиков Г., Мор Г. и др. (1997) ДНК-вакцины: вопросы безопасности и эффективности. Springer Semin Immunopathol 19: 245–256 [PubMed] [Google Scholar]
- Konishi E., Fujii A. (2002) Субвирусные внеклеточные частицы вируса денге 2 типа, продуцируемые стабильно трансфицированной линией клеток млекопитающих, и их оценка для субъединичной вакцины.
 Вакцина
20: 1058–1067 [PubMed] [Google Scholar]
Вакцина
20: 1058–1067 [PubMed] [Google Scholar] - Лай К., Zhao B., Hori H., Bray M. (1991) Инфекционная РНК, транскрибируемая из стабильно клонированной полноразмерной кДНК вируса денге 4 типа. Proc Natl Acad Sci U S A 88: 5139–5143 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мани С., Трипати Л., Раут Р., Тьяги П., Арора У., Барман Т. и др. (2013) Оболочка денге 2, экспрессируемая Pichia pastoris, образует вирусоподобные частицы без предмембранного белка и индуцирует нейтрализующие антитела с высоким титром. PLoS One 8: e64595. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мартин Т., Паркер С., Хедстром Р., Ле Т., Хоффман С., Норман Дж. И др. (1999) Плазмидная ДНК-вакцина против малярии: потенциал для геномной интеграции после внутримышечной инъекции. Хум Джин Тер 10: 759–768 [PubMed] [Google Scholar]
- МакГи К., Цецаркин К., Ванландингем Д., Макелрой К., Ланг Дж., Гай Б. и др. (2008) Замена последовательностей Asibi желтой лихорадки дикого типа на последовательности вакцины 17D в ChimeriVax-dengue 4 не усиливает инфекцию комаров Aedes aegypti.
 J заразить Дис
197: 686–692 [Бесплатная статья PMC] [PubMed] [Google Scholar]
J заразить Дис
197: 686–692 [Бесплатная статья PMC] [PubMed] [Google Scholar] - Мор Г., Сингла М., Стейнберг А., Хоффман С., Окуда К., Клинман Д. (1997) Вызывают ли ДНК-вакцины аутоиммунные заболевания? Хум Джин Тер 8: 293–300 [PubMed] [Google Scholar]
- Морель С., Дидьерлаурент А., Бургиньон П., Делхай С., Барас Б., Якоб В. и др. (2011) Адъювантная система AS03, содержащая α-токоферол, модулирует врожденный иммунный ответ и приводит к повышению адаптивного иммунитета. Вакцина 29: 2461–2473 [PubMed] [Google Scholar]
- Национальные институты здравоохранения (2013) Исследование HBV-001 D1 у здоровых взрослых.http://clinicaltrials.gov/ct2/show/{«type»:»clinical-trial»,»attrs»:{«text»:»NCT00936429″,»term_id»:»NCT00936429″}NCT00936429 (по состоянию на 22 сентября 2013).
- Николс В., Ледвит Б., Манам С., Троило П. (1995) Возможная интеграция ДНК-вакцины в геном клетки-хозяина. Ann N Y Acad Sci 772: 30–39 [PubMed] [Google Scholar]
- Паркер С., Бореллини Ф.
 , Венк М., Хобарт П., Хоффман С., Хедстром Р. и др. (1999) Плазмидная ДНК-вакцина против малярии: исследования тканевого распределения и безопасности на мышах и кроликах.Хум Джин Тер
10: 741–758 [PubMed] [Google Scholar]
, Венк М., Хобарт П., Хоффман С., Хедстром Р. и др. (1999) Плазмидная ДНК-вакцина против малярии: исследования тканевого распределения и безопасности на мышах и кроликах.Хум Джин Тер
10: 741–758 [PubMed] [Google Scholar] - Polo S., Ketner G., Levis R., Falgout B. (1997) Инфекционные РНК-транскрипты из полноразмерных клонов кДНК вируса денге типа 2, полученные в дрожжах. J Virol 71: 5366–5374 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Проммаликит О., Панчароен С., Нисалак А., Тисьякорн У., Тисьякорн С. (2004) Патогенез шокового синдрома денге: усиление иммунитета или вирусная вирулентность. Азиатско-океанический J Педиатр по детскому здоровью 3: 26–29 [Google Scholar]
- Проммаликит О., Thisyakorn U. (2013) Вирулентность вируса денге и тяжесть заболевания. Asian Biomed (в печати). [Google Scholar]
- Равипракаш К., Апт Д., Бринкман А., Скиннер К., Ян С., Дауэс Г. и др. (2006) Химерная четырехвалентная ДНК-вакцина против денге выявляет нейтрализующие антитела ко всем четырем серотипам вируса у макак-резусов.
 Вирусология
353: 166–173 [PubMed] [Google Scholar]
Вирусология
353: 166–173 [PubMed] [Google Scholar] - Rice C., Grakoui A., Galler R., Chambers T. (1989) Транскрипция РНК инфекционной желтой лихорадки из полноразмерных матриц кДНК, полученных лигированием in vitro.Новый Биол 1: 285–296 [PubMed] [Google Scholar]
- Сабчареон А., Ланг Дж., Чантаванич П., Йоксан С., Форрат Р., Аттанат П. и др. (2002) Безопасность и иммуногенность четырехвалентных живых аттенуированных вакцин против денге у взрослых тайских добровольцев: роль концентрации серотипа, соотношения и множественных доз. Am J Trop Med Hyg 66: 264–272 [PubMed] [Google Scholar]
- Сабчареон А., Ланг Дж., Чантаванич П., Йоксан С., Форрат Р., Аттанат П. и др. (2004) Безопасность и иммуногенность трехдозового режима двух четырехвалентных живых аттенуированных вакцин против лихорадки денге для тайских детей в возрасте от пяти до двенадцати лет.Педиатр Infect Dis J 23: 99–109 [PubMed] [Google Scholar]
- Sabchareon A., Wallace D., Sirivichayakul C., Limkittikul K.
 , Chanthavanich P., Suvannadabba S., et al. (2012) Защитная эффективность рекомбинантной живой аттенуированной четырехвалентной вакцины против денге у тайских школьников: рандомизированное контролируемое испытание фазы 2b. Ланцет
380: 1559–1567 [PubMed] [Google Scholar]
, Chanthavanich P., Suvannadabba S., et al. (2012) Защитная эффективность рекомбинантной живой аттенуированной четырехвалентной вакцины против денге у тайских школьников: рандомизированное контролируемое испытание фазы 2b. Ланцет
380: 1559–1567 [PubMed] [Google Scholar] - Санчес В., Хименес С., Томлинсон Б., Чан П., Томас Г., Форрат Р. и др. (2006) Врожденный и адаптивный клеточный иммунитет у не инфицированных флавивирусами людей, реципиентов живой ослабленной вакцины против денге серотипа 3, полученной в клетках Vero (VDV3).Вакцина 24: 4914–4926 [PubMed] [Google Scholar]
- Сарделис М., Эдельман Р., Кляйн Т., Иннис Б., Путнак Дж., Джонс Дж. И др. (2000) Ограниченный потенциал передачи живых вакцин-кандидатов против вируса денге Aedes aegypti и Aedes albopictus. Am J Trop Med Hyg 62: 698–701 [PubMed] [Google Scholar]
- Симмонс М., Берджесс Т., Линч Дж., Путнак Р. (2010) Защита от вируса денге с помощью нереплицирующихся и живых аттенуированных вакцин, используемых вместе в стратегии первичной буст-вакцинации.
 Вирусология
396: 280–288 [PubMed] [Google Scholar]
Вирусология
396: 280–288 [PubMed] [Google Scholar] - Симмонс Дж., Сент-Джон Дж., Рейнольдс Ф. (1931) Экспериментальные исследования денге. Филиппинский J Sci 44: 1–252 [Google Scholar]
- Смакни Дж., Келли Э., Макарти П., Кинг А. (1995) Ответы подкласса иммуноглобулина G мыши после иммунизации живым вирусом денге или рекомбинантным белком оболочки денге. Am J Trop Med Hyg 53: 432–437 [PubMed] [Google Scholar]
- Сан В., Эдельман Р., Канеса-Тасан Н., Экельс К., Путнак Дж., Кинг А. и др. (2003) Вакцинация добровольцев моновалентной и четырехвалентной живой аттенуированной вакциной-кандидатом от денге. Am J Trop Med Hyg 69: 24–31 [PubMed] [Google Scholar]
- Thisyakorn U. (2012) ADVASC — новая региональная инициатива в поддержку перехода от вакцины против денге к вакцинации в Юго-Восточной Азии. Вакцина 30: 5587–5588 [PubMed] [Google Scholar]
- Thisyakorn U., Capeding M., Hadinegoro S., Zulkifli I., Tantwichien T., Goh D., et al. (2013) Подготовка к внедрению вакцины против денге: рекомендации 1-го регионального семинара ADVA (представлены).
 [Google Scholar]
[Google Scholar] - Томас С., Экельс К., Карлетти И., Де Ла, Баррера Р., Десси Ф., Фернандес С. и др. (2013) Фаза II, рандомизированное исследование безопасности и иммуногенности репродуктивной живой аттенуированной вакцины против вируса денге у здоровых взрослых. Am J Trop Med Hyg 88: 73–88 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Вон Д., Шерер Дж., Сан В. (2008) Устойчивость к инфекции. В: Холстед С. (ред.), Денге. Сингапур: Mainland Press Pte, стр. 123–169 [Google Scholar]
- Уоллес Д., Кануэ В., Гарбес П., Вартель Т. (2013) Проблемы клинической разработки вакцины против денге. Curr Opin Virol 3: 352–356 [PubMed] [Google Scholar]
- Ван С., Лин К., Ван С., Чен Ю., Йе Т., Лю Х. и др. (2013) Текущий прогресс в области вакцин против денге. J Biomed Sci 20: 37. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Уэлен Р. (1996) ДНК-вакцины от возникающих инфекционных заболеваний: что, если? Emerg Infect Dis 2: 168–175 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Всемирная организация здравоохранения ((2010) Разработка вакцины против денге: роль Регионального бюро ВОЗ в Юго-Восточной Азии.
 Индия: Всемирная организация здравоохранения. Региональный офис для Юго-Восточной Азии [Google Scholar]
Индия: Всемирная организация здравоохранения. Региональный офис для Юго-Восточной Азии [Google Scholar]
Первая в мире вакцина против денге, полученная в результате исследования SLU: SLU
Вакцина от лихорадки денге, открытая исследователем из Университета Сент-Луиса. в 1997 году и в настоящее время лицензированный по всему миру компанией Санофи Пастер был одобрен для использования в Мексика. Dengvaxia® — первая в мире вакцина, одобренная для предотвращения лихорадки денге, который является вирусом, распространяемым комарами в основном в тропических и субтропических регионах.
Комар Aedes aegypti распространяет лихорадку денге в субтропическом и тропическом климате. Фото пользователя CDC.
«Лихорадка денге — огромная дорогостоящая и изнурительная проблема для здоровья практически во всех развивающихся странах. страны. Это очень болезненно, приводит к попаданию людей в больницу и уносит большие потери.
о здоровье детей «, — сказал Грэм Томас, директор отдела технологий
трансфер в университете Сент-Луиса.
страны. Это очень болезненно, приводит к попаданию людей в больницу и уносит большие потери.
о здоровье детей «, — сказал Грэм Томас, директор отдела технологий
трансфер в университете Сент-Луиса.
«SLU является лидером в области разработки вакцин, и мы гордимся тем, что играем роль в усилиях по предотвращению человеческих страданий и болезней «.
SLU является лидером в области разработки вакцин, и мы гордимся тем, что играем роль в усилиях по предотвращению человеческих страданий и болезней.
По данным Всемирной организации здравоохранения, около половины населения мира подвержено риску развития лихорадки денге, которая
представляет собой растущую угрозу для здоровья.Считается, что о денге не сообщают, а
390 миллионов заражений в год. С симптомами, похожими на грипп, денге поражает
младенцы, маленькие дети и взрослые. Редкая и тяжелая форма денге может быть смертельной,
вызывая обширное кровотечение под кожей и внутри тела.
С симптомами, похожими на грипп, денге поражает
младенцы, маленькие дети и взрослые. Редкая и тяжелая форма денге может быть смертельной,
вызывая обширное кровотечение под кожей и внутри тела.
Университет Сент-Луиса имеет патент на вакцину, которая была разработана в 1997 году. Томас Чемберс, М.Н., Затем доцент кафедры молекулярной микробиологии и иммунология. Находясь в SLU, Чемберс изучал флавивирусы, которые обычно распространяются комарами в жарком, дождливом климате. Впоследствии он сделал карьеру в частном секторе. промышленность.
Биофармацевтическая компания, которая стала Acambis Inc., получила права на вакцины.
разработан в SLU для профилактики денге, японского энцефалита и Западного Нила.Акамбис позже
сотрудничал с Санофи Пастер для проведения клинических испытаний вакцины на людях в Азии,
Африка и Латинская Америка. Акамбис был приобретен Санофи в 2008 году.
Акамбис был приобретен Санофи в 2008 году.
Хотя Мексика является первой страной, одобрившей использование вакцины против денге, нормативные Правления в других странах, где лихорадка денге является эндемическим заболеванием, рассматривают вопрос о лицензировании вакцина. В пресс-релизе Санофи сообщила, что произвела первые дозы вакцины.При работе на полную мощность производственных мощностей, Санофи рассчитывает производить 100 миллионов доз вакцины в год.
коз и газировка:
NPRНа слушаниях в Сенате Филиппин 21 февраля 2018 года в Маниле по поводу смертей, связанных с вакциной против денге, семьи принесли фотографии вакцинированных детей. Ноэль Селис / AFP / Getty Images скрыть подпись
переключить подпись Ноэль Селис / AFP / Getty Images в феврале. 21 ноября 2018 г., в Сенате Филиппин в Маниле слушали слушания по поводу смертей, связанных с вакциной против денге, семьи принесли фотографии вакцинированных детей.
21 ноября 2018 г., в Сенате Филиппин в Маниле слушали слушания по поводу смертей, связанных с вакциной против денге, семьи принесли фотографии вакцинированных детей.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США только что одобрило одну из самых востребованных вакцин за последние десятилетия. Это первая в мире вакцина для предотвращения лихорадки денге — болезни, настолько болезненной, что ее прозвали «ломкой».
Вакцина под названием Dengvaxia предназначена для помощи детям в Пуэрто-Рико и других странах.S. территории, где денге представляет собой проблему .
Но у этой вакцины мрачная и смертельная история. Тот, который привел к уголовным обвинениям на Филиппинах, вызвал национальную панику и спровоцировал массовую вспышку кори, в результате которой уже погибло более 355 человек.
Концерн
Эта история начинается на сцене в Маниле в 2016 году.
Молодая девушка примерно 9 или 10 лет сидела на стуле в окружении сотрудников здравоохранения. На ней была ярко-желтая футболка с надписью «Денге опасна».Она зажмурилась и закусила губу, когда министр здравоохранения Филиппин доктор Джанетт Гарин сделала ей укол в руку.
Этот выстрел запустил массовую кампанию вакцинации по вакцинации Dengvaxia почти 1 миллион школьников. Цель заключалась в том, чтобы спасти тысячи жизней детей и предотвратить примерно 10 000 госпитализаций за пятилетний период.
Но, в конце концов, по оценкам, более 100 000 филиппинских детей получили вакцину, которая, по словам представителей здравоохранения, повысила их риск тяжелого, а иногда и смертельного заболевания.Кроме того, другие дети, получившие вакцину, могли оказаться в опасности, потому что, как утверждали их родители, у них было плохое здоровье.
Французская фармацевтическая компания Sanofi Pasteur потратила 20 лет и около 2 миллиардов долларов на разработку Dengvaxia. Компания провела несколько крупных испытаний с участием более 30 000 детей по всему миру и опубликовала результаты в престижном медицинском журнале New England Journal of Medicine .
Компания провела несколько крупных испытаний с участием более 30 000 детей по всему миру и опубликовала результаты в престижном медицинском журнале New England Journal of Medicine .
Но на полпути от Филиппин, в Вашингтоне, округ Колумбия.С., пригород, один ученый забеспокоился о новой вакцине.
«Когда я прочитал статью New England Journal , я чуть не упал со стула», — говорит доктор Скотт Холстед, который более 50 лет изучал лихорадку денге в армии США. Когда Холстед изучил данные о безопасности вакцины в клинических испытаниях, он сразу понял, что существует проблема.
Для некоторых детей вакцина не подействовала. На самом деле, говорит Холстед, это оказалось вредным.Когда эти дети заразились лихорадкой денге после вакцинации, вакцина в некоторых случаях усугубила течение болезни. В частности, для детей, которые никогда не сталкивались с лихорадкой денге, вакцина, по-видимому, увеличивала риск смертельного осложнения, называемого синдромом утечки плазмы, при котором из кровеносных сосудов начинает вытекать желтая жидкость крови.
«Потом все становится хуже, и, может быть, уже невозможно спасти свою жизнь», — говорит Холстед. «Ребенок может впасть в шок».
«Проблема в том, что болезнь возникает очень быстро, всего за несколько часов», — добавляет он.«И на внешней стороне тела нет ничего, что указывало бы на то, что у человека течет жидкость изнутри».
«Это редкое осложнение», — говорит Холстед. Тем не менее, его так беспокоили проблемы безопасности, что он написал по крайней мере шесть передовых статей для научных журналов. Он даже снял видео, чтобы предупредить правительство Филиппин о проблеме.
«Я просто думаю:« Нет, нельзя делать вакцину совершенно нормальному здоровому человеку, а затем подвергать его повышенному риску на всю оставшуюся жизнь синдрома утечки плазмы », — говорит Холстед.«Вы не можете этого сделать».
Производитель вакцины не согласился с интерпретацией результатов исследования Холстедом. Компания написала опровержение, утверждая, что регулирующие органы одобрили Dengvaxia «на основании доказанной защиты вакцины и приемлемого профиля безопасности».
Компания также заявила, что проведет дополнительные исследования для «дальнейшего изучения безопасности, действенности и эффективности» вакцины.
Несмотря на эти опасения, в июле 2016 года Всемирная организация здравоохранения порекомендовала вакцину для всех детей в возрасте от 9 до 16 лет.
«Да, мы сделали. Это было то, что мы называем« условной рекомендацией »с упором на минимизацию потенциальных рисков», — говорит д-р Йоахим Хомбах, возглавлявший обзор вакцины ВОЗ. «Мы видели проблемы. Мы также четко указали на пробелы в данных».
ВОЗ рекомендовала Санофи провести больше экспериментов, чтобы лучше понять проблемы безопасности вакцины. В своей оценке ВОЗ указала, что вакцина «может быть неэффективной или теоретически может даже увеличить будущий риск [быть] госпитализирован или тяжелой болезнью денге» у людей, которые никогда не подвергались лихорадке денге, что составляет около 10% от 20% филиппинских детей.
Рекомендация ВОЗ была дана через три месяца после того, как Филиппины начали свою кампанию массовой вакцинации в апреле 2016 года.
Полтора года спустя эта кампания резко остановилась.
Проблема
В ноябре 2017 года Санофи опубликовала на своем веб-сайте объявление о новой информации о безопасности Dengvaxia.
Опасения Холстеда подтвердились. Санофи обнаружила доказательства того, что вакцина увеличивает риск госпитализации и синдрома утечки цитоплазмы у детей, которые ранее не подвергались лихорадке денге, независимо от возраста.
«Людям, которые ранее не были инфицированы вирусом денге, вакцинация не рекомендуется», — написали в компании.
Паника поразила Филиппины. В новостях родители заявили, что вакцина стала причиной смерти 10 детей. Вспыхнули протесты. Конгресс Филиппин начал расследование покупки вакцины и кампании иммунизации. А чиновники здравоохранения Филиппин начали проводить вскрытия детей, которые умерли после вакцинации.«В общей сложности смерть около 600 детей, получивших Dengvaxia, расследуется прокуратурой», — сообщила в прошлом месяце South China Morning Post . Следователи пока не обнародовали свои результаты.
Следователи пока не обнародовали свои результаты.
Вот проблема с Dengvaxia.
Обычно вакцина работает, заставляя иммунную систему вырабатывать антитела против вируса. Эти антитела затем борются с вирусом во время инфекции.
Но денге — хитрый вирус.Антитела денге не всегда защищают человека. Фактически, эти антитела могут усугубить инфекцию. Вирус денге фактически использует антитела, чтобы помочь ему распространиться по телу. Таким образом, вторая инфекция денге — когда в вашей крови уже есть антитела — может быть хуже, чем первая; человек подвергается более высокому риску серьезных осложнений, таких как синдром утечки плазмы.
В своем последующем исследовании Санофи обнаружила доказательства того, что Dengvaxia действует как первая инфекция для человека, который ранее не был инфицирован.Организм вырабатывает антитела против вакцины, которые обладают аналогичным потенциалом вреда.
Повышенный риск кажется небольшим. Вакцина повышает риск госпитализации после инфекции денге примерно с 1,1% до 1,6%, как показало последующее исследование, проведенное Санофи. Таким образом, по оценкам Санофи, из 1 миллиона детей на Филиппинах вакцина приведет к госпитализации около 1000 детей в течение пяти лет. (С другой стороны, вакцина предотвратит около 12000 госпитализаций по поводу новой инфекции денге у детей, которые ранее уже были инфицированы денге в течение того же периода времени.)
Таким образом, по оценкам Санофи, из 1 миллиона детей на Филиппинах вакцина приведет к госпитализации около 1000 детей в течение пяти лет. (С другой стороны, вакцина предотвратит около 12000 госпитализаций по поводу новой инфекции денге у детей, которые ранее уже были инфицированы денге в течение того же периода времени.)
Но в мире вакцин это недопустимый риск. Риск должен быть чрезвычайно малым, чтобы его можно было терпеть. Например, по данным ВОЗ, с вакциной против кори риск энцефалита составляет примерно 1 из 1 миллиона, что в 1000 раз меньше, чем риск заражения корью.
В конце концов ВОЗ изменила свою рекомендацию. В настоящее время агентство заявляет, что вакцина безопасна только для детей, перенесших ранее инфекцию денге.
К тому времени, когда Санофи осознала наличие проблемы с вакциной, вакцинировали около 800 000 филиппинских детей.По оценкам исследования Sanofi, более 100 000 из них никогда не были инфицированы лихорадкой денге и не должны были получить прививку, согласно пересмотренной рекомендации ВОЗ.
Учитывая опасения Холстеда и первоначальные сведения о безопасности вакцины, филиппинские родители должны были быть предупреждены о потенциальном риске, говорит д-р Изабель Родригес из Калифорнийского университета в Сан-Франциско.
«В этой истории меня больше всего беспокоит информирование о рисках», — говорит Родригес, изучающий лихорадку денге в Южной Америке.«С самого начала было много неуверенности [относительно безопасности вакцины]. Об этом нужно было сообщить прямо. Вы должны быть честными в отношении имеющихся доказательств».
Доктор Су-Пинг Нг, глобальный медицинский руководитель Sanofi Pasteur, говорит, что компания следовала всем рекомендациям Всемирной организации здравоохранения при разработке вакцины и честно общалась на протяжении всего процесса. «Мы всегда очень прозрачно делились результатами наших исследований», — говорит Нг. «И я просто хочу подчеркнуть, что мы полностью уверены в нашей вакцине, поскольку она одобрена регулирующими органами более чем в 20 странах.
Оглядываясь назад, Нг говорит, что Санофи не сделала бы ничего по-другому при разработке вакцины: «Нет, мы были очень, очень близки с исследовательским сообществом, тесно сотрудничая с ними в течение последних 20 лет в этих усилиях. найти решение для нужд общественного здравоохранения ».
Последствия
В апреле правительство Филиппин предъявило обвинение 14 правительственным чиновникам в смерти 10 детей, получивших вакцину Dengvaxia. Правительство заявило, что официальные лица действовали« излишне поспешно. «в закупке вакцины и запуске кампании массовой иммунизации.Министерство юстиции Филиппин заявило, что кампания началась до завершения клинических испытаний
В некоторых случаях детям вводили вакцину неподготовленными медицинскими работниками и, как утверждается, без предварительного медицинского осмотра. У некоторых детей якобы уже были заболевания, которые делали иммунизацию опасной. Но, как выяснило правительство, этим детям все же сделали прививки.
Шесть сотрудников Санофи также были обвинены в ненадлежащей помощи детям, которые серьезно отреагировали на выстрел.Санофи оспаривает это и другие обвинения, добавив в письменном заявлении для NPR: «Мы категорически не согласны с выводами Министерства юстиции, сделанными в отношении должностных лиц Санофи (нынешних и прошлых), и мы будем решительно их защищать. Нет никаких клинических доказательств того, что какие-либо зарегистрированные смертельные случаи были причинными. связанных с вакцинацией.
«Мы внимательно следим за безопасностью людей, участвующих в клинических исследованиях. Мы также проводим мероприятия по фармаконадзору и постоянно отслеживаем профиль безопасности вакцины в реальных условиях, в том числе на Филиппинах.»
Независимо от того, чем завершатся эти испытания, фиаско на Филиппинах является ключевым уроком для правительств и производителей, когда дело доходит до утверждения и продажи новых вакцин: замедляйтесь, — говорит врач и специалист по биоэтике Кеймантри Мудли. Ошибки с вакцинами могут подрывают доверие общества и имеют долгосрочные последствия для здоровья всей страны.
«Когда вакцина выходит из строя, это вызывает страх и беспокойство у населения, особенно у родителей», — говорит Мудли, руководитель Центра по медицинской этике и праву в Стелленбошском университете в Южной Африке.«Этот страх может негативно повлиять на установленные иммунные программы, которые на самом деле безопасны и работают очень хорошо».
После споров о Dengvaxia доверие к вакцинам среди филиппинских родителей упало с 82% в 2015 году до 21% в 2018 году, как показало недавнее исследование. За тот же период доля родителей, которые твердо верят, что вакцины важны, упала с 93% до 32%.
В результате охват вакцинами против детских болезней на Филиппинах, таких как корь, снизился, сообщает ВОЗ.А на Филиппинах сейчас наблюдается крупная вспышка кори, в которой за 2019 год зарегистрировано более 26 000 случаев заболевания и более 355 смертей.
Здесь, в США, одобрение вакцины — для использования в Пуэрто-Рико, США и Британских Виргинских островах. и Гуам — имеет важное ограничение: врачи должны иметь доказательства перенесенной лихорадки денге, чтобы вакцина не представляла опасности для ребенка. Этой гарантии у филиппинских семей никогда не было.
границ | Проблемы разработки вакцин против денге: ранее существовавшие инфекции и перекрестная реактивность
Эпидемиология инфекции денге
Денге представляет собой глобальную угрозу для здоровья в тропических и субтропических странах с огромным количеством инфекций денге, которые, по оценкам, составляют более 390 миллионов случаев ежегодно.Среди них у ~ 96 млн человек развиваются клинические патологии (1). В 2019 году во всем мире было зарегистрировано множество случаев инфекции денге, из которых более 3 миллионов случаев были подтверждены Панамериканской организацией здравоохранения (ПАОЗ). Большинство случаев было зарегистрировано в Бразилии, где, по оценкам, в 2019 году было 1,5 миллиона (ПАОЗ). Это более чем в 10 раз больше, чем годом ранее. Помимо стран Южной Америки, инфекция денге встречается во многих странах Азии и Юго-Восточной Азии, включая Бангладеш, Малайзию, Мальдивы и Филиппины, где наблюдается резкий рост случаев инфицирования денге.Страны Индийского океана, Австралии и Тихого океана также сообщили о многих случаях денге. Полный список стран с инфекцией денге приведен в таблице 1. Инфекции денге представляют собой не только проблему для здоровья, но и огромное экономическое бремя, которое, по оценкам, в 2016 году составило ~ 5,71 миллиарда долларов в год (2). Это экономическое бремя резко возросло по сравнению с оценкой 2013 года, которая составляла 1,51 миллиарда долларов, и, вероятно, будет продолжать расти ежегодно (2). Таким образом, существует острая необходимость в разработке вакцины от денге, и это подтверждается совместными международными усилиями многих всемирных организаций здравоохранения и федеральных учреждений.
Таблица 1 . Список всех случаев денге по годам и странам.
Клинические проявления инфекции денге
Существует три фазы инфекции денге: лихорадочная фаза, критическая фаза и фаза выздоровления. Лихорадочная фаза — это начальная фаза, которая обычно начинается с высокой температуры, которая проявляется рядом гриппоподобных симптомов, включая рвоту, головные боли, миалгию и боль в суставах. Эта фаза длится около недели, и большинство людей выздоравливают без дальнейших осложнений (3).Критическая фаза или фаза, угрожающая жизни, — это то место, где возникает большинство тяжелых симптомов, таких как внутреннее кровотечение и утечка плазмы. Во время фазы восстановления проницаемость сосудов возвращается к норме, и симптомы начинают быстро исчезать (3) (Рисунок 1). В целом, наиболее тяжелой формой заболевания является развитие геморрагической лихорадки денге (DHF) и шокового синдрома денге (DSS), оба из которых связаны с антителозависимым усилением (ADE) (4, 5). ADE возникает, когда антитело, которое ранее генерировалось к одному из четырех серотипов, связывается, но не нейтрализует другой серотип денге.Это связывание затем облегчает проникновение вирусов через рецепторы FC, что приводит к усилению виремии (5).
Рисунок 1 . Первичная инфекция денге с указанием сроков диагностического тестирования.
Вирусология вируса денге
Вирус денге (DENV) — это патоген, переносимый членистоногими, который заражает людей при укусе инфицированного комара (6). Вирусом денге могут быть инфицированы два типа комаров: Aedes aegypti или Aedes albopictus (1).Дендритные клетки (ДК) и макрофаги в первую очередь поражаются вирусом в первые дни заражения вирусом денге (7). Передача от человека к человеку отсутствует, и вирус передается только через комаров при взятии крови у виремического человека. Виремия и системная инфекция могут возникать из-за лимфотропных характеристик вируса, при котором DENV поражает дренирующие кожу лимфатические узлы (dLN) и клетки, которые проникают в них, такие как DC и моноциты (8).
DENV представляет собой оболочечный вирус, который состоит из РНК с положительной цепью, которая принадлежит к роду Flavivirus семейства Flaviviridae.Когда вирус созревает, он включает три структурных белка, а именно нуклеокапсид (C), оболочку (E) и мембрану (M), и семь неструктурных белков (NS1, NS2A, NS2B, NS3, NS4A, NS4B и NS5). (9). Они играют важную роль в репликации вирусного генома, уклонении и модуляции иммунной системы, сборке вирионов и синтезе вирусного генома (10). DENV имеет четыре антигенно различных серотипа (DENV1-4), которые имеют до 65% общего вирусного генома (11, 12). Различия в серотипах создают серьезную проблему для разработки вакцины против денге.Вирус денге проникает в клетку-хозяина посредством различных путей интернализации, таких как эндоцитоз клатрин-зависимого рецептора при связывании с родственным рецептором. Во время естественной инфекции DENV в первую очередь инфицирует клетки, несущие рецепторы лектина С-типа на клетках мононуклеарного клона фагоцитов, таких как моноциты, DC и макрофаги. Такими рецепторами лектина С-типа являются, например, DC-специфическая молекула внутриклеточной адгезии 3 (ICAM-3) и захватывающий неинтегрин (DC-SIGN, CD209) (6). При вторичных инфекциях DENV зависит от ранее существовавших антител, которые поглощаются клетками-мишенями, несущими рецептор Fcγ, для проникновения в клетки-хозяева.Попадая в клетку посредством эндоцитоза, DENV может ускользать из эндосомы из-за pH-зависимого конформационного изменения и высвобождать свой геном в цитоплазму (13). После трансляции структурных и неструктурных белков капсид и геном связываются вместе, образуя нуклеокапсид в цитоплазме. Нуклеокапсиды по неизвестному механизму направляются в ER и почку в просвет ER для приобретения билипидной мембраны, покрытой белками prM / M и белками E (6, 13). Это сформирует незрелый вирус шиповидной формы, который затем будет направлен в аппарат Гольджи для дополнительных структурных изменений в prM.Слабокислый pH сети транс-Гольджи (TGN) и присутствие фурина эндопротеазы клетки-хозяина позволяют расщеплению prM генерировать зрелый, ассоциированный с вирионом M гладкой мраморной формы и растворимый пептид (14).
Важно подчеркнуть значительную роль DENV в регуляции клеточного липидного метаболизма и аутофагии для усиления репликации, созревания и производства инфекционных вирионов. Зрелые вирионы и гексамеры NS1 покидают инфицированную клетку через секреторный путь хозяина (13) (рис. 2).Стоит отметить, что было показано, что концентрация секретируемого NS1 положительно коррелирует с тяжестью заболевания, поскольку высокое количество NS1 связано с DHF и DSS (15). Предлагаемый механизм заключается в том, что NS1 связывается с тромбоцитами через toll-подобный рецептор (TLR) 4, активируя тромбоциты, и индуцирует экспрессию маркера активации P-селекции и маркера апоптоза фосфатидилсерина (PS) на поверхности тромбоцитов. Экспрессия P-селекции на поверхности увеличивает адгезию к эндотелиальным клеткам, а воздействие PS запускает фагоцитоз макрофагами, что приводит к тромбоцитопении при инфекциях денге (рис. 2).Эта адгезия к эндотелиальным клеткам также вызывает утечку из сосудов и может вызвать цитокиновый шторм (16). NS1 может также усиливать агрегацию тромбоцитов в присутствии аденозиндифосфата (АДФ), который секретируется активированными тромбоцитами. Таким образом, взаимодействие TLR4 / NS1 запускает активацию, агрегацию и апоптоз тромбоцитов (16).
Рисунок 2 . Графическое представление жизненного цикла DENV и нарушения врожденного иммунного ответа: вирус проникает в клетку-хозяина через рецептор-опосредованный эндоцитоз или усиление, зависящее от антител.После эндоцитоза вируса вирусная РНК покидает эндосому с последующей трансляцией РНК в ER и репликацией в цитоплазме. Затем вновь реплицированный вирусный геном собирается с белком C с образованием нуклеокапсида, который прорастает в ER, чтобы получить липидную мембрану, покрытую белками prM / M и E. Вирион выходит из ER в виде незрелого вириона, который имеет шипастый вид. Для дальнейшего созревания вирион перемещается в аппарат Гольджи, где белок prM расщепляется клеточной эндопротеазой фурином с образованием зрелого вириона, который существует в клетке через секреторные пути и заражает новые клетки.Неструктурные белки (NS1, NS2A, NS2B, NS3, NS4A, NS4B и NS5) DENV имеют различные механизмы уклонения. Эти механизмы уклонения включают нарушение сигнальных каскадов TLR, RIG-I и MDA5, подавление IFN α / β-опосредованных противовирусных ответов, расщепление MITA / STING, вмешательство в ответ RNAi, усиление репликации вируса за счет индукции аутофагии, ингибирование расщепления двойного белка. цепная РНК ферментом Dicer, подавление ISG, ингибирование восходящего и нисходящего пути MAVS, ингибирование фосфорилирования STAT1 и деградация STAT2.Наконец, неструктурные белки способны вызывать активацию, агрегацию и апоптоз тромбоцитов, что приводит к утечке из сосудов и тромбоцитопении (красные стрелки обозначают различные меры противодействия, которые были разработаны денге для уклонения и / или предотвращения противовирусного врожденного иммунного ответа. противовирусный ответ против DENV указан черными стрелками).
Иммунный ответ на вирус денге
Врожденный иммунитет
Продукция интерферонов (IFN) — это первая линия защиты от DENV, которая может контролировать раннюю репликацию вируса в клетках-мишенях (6).Как только DENV попадает в кожу, он распознается рецепторами распознавания образов (PRR), такими как TLR и рецепторы лектина C-типа, которые экспрессируются на иммунных часовых (8). Активация PRR усиливает противовирусные врожденные иммунные ответы за счет активации нижестоящего пути, ведущего к продукции интерферонов (IFN) и фактора некроза опухоли (TNF) (17). Стимуляция TLR-3 и -7 индуцирует продукцию IFN-α и IFN-β. Продукция IFN-αβ играет решающую роль в подавлении инфекции DENV. Полученные IFN связываются с рецепторами IFN, экспрессирующимися на клетках аутокринным и паракринным образом.Это связывание приводит к активации пути JAK / STAT, следовательно, к продукции более 100 эффекторных белков (18). Все вышеупомянутые ответы будут стимулировать созревание DC и активацию B- и T-клеток и, следовательно, будут способствовать адаптивному иммунному ответу. Тем не менее, DENV разработал несколько стратегий по захвату механизмов IFN. Белок NS1 секретируется инфицированными клетками в виде гексамера в сыворотку крови пациента. Протеаза NS2B / 3 из DENV обладает способностью вмешиваться в пути индукции IFN α / β для подавления противовирусных ответов за счет расщепления человеческого медиатора активатора фактора регуляции интерферона 3 (IRF3) (MITA или STING) (19).Кроме того, неструктурные белки DENV (NS2A, NS4A и NS4B) могут частично блокировать сигнальный путь STAT, который, в свою очередь, мешает передаче сигналов IFN между клетками (20) (рис. 2).
Внутриклеточные сенсоры, такие как белок 5, связанный с дифференцировкой меланомы геликазы (MDA5) и ген 1, индуцируемый ретиноевой кислотой (RIG-I), также считаются первой линией защиты, которая способна распознавать вирусную РНК и участвует в Продукция IFN-β (13). И RIG-I, и MDA5 участвуют в продукции IFN-β (21).При вторичных инфекциях DENV, образующий комплекс с ненейтрализующими антителами, инфицирует клетки, несущие рецептор Fc γ , способом, известным как зависимое от антител усиление (ADE). ADE вызывает подавление передачи сигналов TLR, а также вмешательство в каскады передачи сигналов RIG-I и MDA5, вызывая ингибирование IFN α / β-опосредованного противовирусного ответа (13). Во время активации RIG-I RIG-I распознает вирусную РНК и перемещается в митохондрии, где взаимодействует с адаптерным белком, называемым митохондриальным антивирусным сигнальным белком (MAVS).Взаимодействие RIG-I / MAVS индуцирует развитие агрегатов MAVS, которые служат иммунной сигнаносомой, активирующей фактор транскрипции IRF3 и ядерный фактор kB (NF-κB). После этого эти факторы транскрипции перемещаются в ядро и индуцируют продукцию IFN типа I.
DENV разработал стратегии уклонения для подавления выше и ниже пути MAVS. Белок DENV NS3 способен предотвращать транслокацию RIG-I в митохондрии (22). С другой стороны, NS4A способен связываться с доменами MAVS CARD и эффективно предотвращать взаимодействие RIG-I / MAVS (23).Путь интерференционной РНК (RNAi) является жизненно важным противовирусным ответом, однако DENV разработал несколько механизмов, чтобы вмешиваться или уклоняться от него. Наиболее хорошо изученным из этих механизмов является генерация субгеномной РНК флавивируса (sfRNA) из 3′-нетранслируемой области вирусной РНК (vRNA) (24). Производство sfRNA ингибирует расщепление двухцепочечной РНК ферментом Dicer, препятствуя врожденному противовирусному иммунитету. Другая стратегия, которая была разработана для вмешательства в путь РНКи, — это экспрессия субструктурного белка NS4B, который может модулировать путь РНКи / миРНК хозяина, способствуя репликации DENV (25).Белок NS5 способен предотвращать продукцию IFN, подавляя IFN-стимулированные гены (ISG) за счет ингибирования рекрутирования транскрипционного комплекса PAF1C (26). Как упоминалось выше, неструктурные белки денге взаимодействуют с врожденным иммунитетом, изображенным на рисунке 2. Было показано, что активированные тучные клетки в коже являются ответственной клеткой за инициацию рекрутирования цитотоксических клеток, включая естественные клетки-киллеры (NK). киллерные Т-клетки (NKT) и CD8 + Т-клетки. Привлечение цитотоксических клеток к месту инфекции способствует удалению вируса и ограничивает инфекцию в дренирующих лимфатических узлах (27).Помимо решающей роли DC в производстве IFN, TNF и блокировании распространения и репликации вируса, DC также связывают врожденный иммунный ответ с адаптивным иммунным ответом, представляя антиген Т-клеткам после миграции в дренирующие LN (8 ).
Адаптивный иммунитет (Т-клетки)
Сообщалось, чтоТ-клетки обладают как патологической, так и защитной функцией во время инфекции денге. Денге-инфицированные DC представляют антиген CD8 + и CD4 + Т-клеткам в Т-клеточных зонах дренирующего ЛУ, где начинается адаптивный иммунный ответ.Активированные CD4 + T-клетки затем будут оказывать помощь CD8 + T-клеткам, которые затем смогут напрямую убивать инфицированные денге клетки путем распознавания различных белков денге, включая неструктурные белки NS3 и NS1.2a (8, 28). В бессимптомных случаях наблюдалось большое количество активированных CD4 + Т-клеток в борьбе с инфекцией денге, что демонстрирует ее защитную роль. CD8 + Т-клетки в основном направлены против неструктурных белков, тогда как CD4 + Т-клетки смещены в сторону эпитопов оболочки, капсида и NS1 (29).Сообщалось, что в ответах иммунного отзыва на вторичную инфекцию DENV наличие гетерологичной памяти и перекрестно-реактивного CD4 + T, специфичного для первичного серотипа DENV, будет усугублять иммунную патологию (30).
Современные вакцины против денге
Вакцина лицензированная
Разработка эффективной вакцины против денге является сложной задачей из-за того, что DENV имеет четыре серотипа, причем все четыре типа способны вызывать заболевание. Кроме того, ADE, который индуцируется уже существующими антителами против DENV, создает препятствие для разработки вакцины, поскольку для обеспечения защиты необходимо генерировать нейтрализующие антитела ко всем серотипам денге (31).Тем не менее, есть несколько многообещающих кандидатов на вакцину против денге, которые проходят клиническую оценку (32, 33). На данный момент Dengvaxia (CYD-TDV), разработанная Санофи Пастер, является единственной вакциной, лицензированной и используемой во многих странах мира с 2015 г. (34, 35). Эта вакцина представляет собой живую аттенуированную химерную четырехвалентную вакцину с остовом вируса штамма желтой лихорадки 17D (36, 37). Белки prM и E желтой лихорадки заменены белками prM и E четырех серотипов DENV (37). Эту вакцину разрешено вводить только серопозитивным лицам в возрасте от 9 до 45 лет в странах, эндемичных по денге. Она вводится подкожно серией из трех доз с интервалом в 6 месяцев (0, 6, 12 месяцев) (35) .Несмотря на то, что CYD-TDV продемонстрировал большую эффективность в защите от тяжелого заболевания у лиц с положительной реакцией на денге, он подвергает серонегативных лиц повышенному риску развития тяжелой болезни денге (38). По этой причине исследования по поиску других возможных вакцин против лихорадки денге все еще продолжаются. Есть несколько других вакцин-кандидатов, которые проходят клинические испытания на различных продвинутых стадиях, от фазы I до фазы III. К ним относятся платформы живых аттенуированных, очищенных инактивированных и ДНК-вакцин (39–43) (рис. 3).
Рисунок 3 . Современные вакцины против денге.
Вакцины III фазы
TV003 / TV005 (NCT01506570) и TDV / DENVax / TAK003 (NCT02302066) — два многообещающих живых аттенуированных вакцины-кандидата, которые в настоящее время проходят фазу 3 клинических испытаний (39, 40). Вакцина-кандидат TV003 / TV005 — это живая аттенуированная вакцина, разработанная Национальным институтом аллергии и инфекционных заболеваний NIAID / NIH (44). Эта вакцина содержит смесь четырех живых аттенуированных серотипов денге (4).Доказано, что вакцина TV003 индуцирует нейтрализующие антитела ко всем четырем серотипам у людей. Эта вакцина содержит 10 3 БОЕ каждого из четырех серотипов денге 1, 2, 3 и 4 (4). TV005 идентичен TV003 только с более высокой дозой 10 4 БОЕ компонента DENV2. Обе вакцины показали многообещающие результаты в клинических испытаниях, при этом TV003 вызывал наивысший устойчивый иммунный ответ на все серотипы DENV (DENV1-4) после однократной дозы (31, 44). TDV, также известный как DENVax / TAK003, представляет собой химерную четырехвалентную живую аттенуированную вакцину, разработанную Takeda / Inviragen (NCT01511250).Эта вакцина состоит из химеры белков prM и E серотипов DENV1, 3 и 4 на основе всего живого аттенуированного остова DENV2 PDK53 (45). Было показано, что он индуцирует титры нейтрализующих антител против всех серотипов DENV, а также способность вызывать гуморальные и клеточные ответы (46, 47) (Рисунок 3).
Фаза II, I, доклинические вакцины
TDEN-LAV (NCT01702857) (36) и TDEN-PIV (NCT01666652) (37) — две другие вакцины-кандидаты, разработанные Исследовательским институтом армии Уолтера Рида (WRAIR) и GlaxoSmithKline Vaccines (GSK).TDEN-LAV — это живая аттенуированная четырехвалентная вакцина, требующая двух доз, которая содержит четыре серотипа DENV и в настоящее время проходит фазу II клинических испытаний. Он подвергся последовательному пассированию в первичных клетках почки собаки (PDK) и еще трем пассажам в клетках легкого резуса плода (FRhL) для снижения инфекционности. TDEN-LAV был приготовлен в двух разных формах, названных F17 и F19, причем оба они хорошо переносились здоровыми взрослыми независимо от их предыдущего статуса примирования вирусом денге. Состав F17 давал стабильные титры для всех четырех серотипов, в то время как состав F19 имел потерю инфекционности с DENV-4.Во время испытания у реципиентов вакцины, не подвергнутых праймированию, не развились реакции на все 4 серотипа после первой дозы вакцины, но обе композиции вызвали иммуногенность по всем подтипам после 2 доз. Однако уровень нейтрализующих антител не измерялся и поэтому неизвестен.
Платформы живых аттенуированных вакцин имеют одну оговорку: часто у субъектов исследования вырабатываются антитела только против одного доминирующего серотипа, а не против всех включенных. Для борьбы с этой проблемой было разумно разработать платформу инактивированной вакцины против денге.TDEN-PIV (DPIV) — это очищенная, инактивированная формалином четырехвалентная вакцина против DENV, которая в настоящее время проходит фазу I клинических испытаний (37). DPIV был составлен с квасцами или адъювантными системами AS01 E или AS03 B с двумя различными концентрациями антигена. Схема вакцинации включает три дозы, одну начальную дозу с двумя ревакцинациями. Все участники исследования были серо-отрицательными по всем четырем серотипам на момент введения вакцины. Все составы хорошо переносились участниками исследования и были умеренно иммуногенными против всех четырех серотипов, однако наблюдалось снижение и плато нейтрализующих антител (48, 49).
Другой кандидат на вакцину Фазы I, D1ME100 / TVDV, разрабатывается Военно-морским медицинским исследовательским центром (NMRC), США (NCT002
) (43). Это моновалентная ДНК-вакцина с плазмидным вектором, экспрессирующим гены prM и E DENV-1 под контролем цитомегаловирусного промотора плазмидного вектора VR1012. Вакцина была протестирована на участницах, ранее не получавших денге, и иммуногенность и безопасность были определены после трех доз. ДНК-вакцины обладают рядом преимуществ, включая мощные ответы CTL и способность сохранять гуморальный иммунитет.Это достигается путем производства неживых, нереплицирующихся и нераспространяющихся антигенов, что по существу приводит к имитации естественной инфекции (50). D1ME100 / TVDV индуцировали гамма-ответы против Т-клеточного IFN денге, но только у 5 из 12 пациентов, получавших препарат в высоких дозах, обнаруживались ответы нейтрализующих антител, которые, хотя и продолжались, были низкими (43, 51), что указывает на то, что вакцина TVDV быть безопасным и благоприятно реактогенным, но без важных гуморальных реакций (43).
В разработке вакцины имеется много рекомбинантных субъединичных вакцин-кандидатов.V180 (DEN-80E) MERCK (NCT01477580) — одна из наиболее многообещающих вакцин-кандидатов, прошедшая фазу I клинических испытаний (52). Это вакцина на основе белка оболочки, содержащая 80% N-конца белка оболочки (DEV-80E) для всех четырех серотипов DENV, полученных с использованием линии клеток S2 Drosophila (53). В доклиническом испытании использовалась смесь этой вакцины-кандидата с адъювантом ISCOMATRIX ™ на мышах и обезьянах, чтобы продемонстрировать эффективность индукции сильных нейтрализующих антител против всех серотипов DENV и защиты от вирусемии (53, 54).В клиническом исследовании фазы I MERCK использовались взрослые добровольцы, ранее не инфицированные флавивирусами, которым вводили составы V180, включая адъювант ISCOMATRIX ™. Участники исследования показали устойчивый положительный иммунитет, но составы с алюминиевым адъювантом и без адъювантов были слабо иммуногенными. Было показано, что вакцина в сочетании с ISCOMATRIX ™ ассоциировалась с более благоприятными событиями по сравнению с препаратами с алюминием и препаратами без адъюванта, и в целом все препараты хорошо переносились (55) (Рисунок 3).
Несколько других вакцин-кандидатов с различными платформами проходят доклинические испытания на мышах и нечеловеческих приматах, включая вирус-вектор (56–58), рекомбинантный белок (59–61) и вирусоподобные частицы (VLP) (62–64). ) вакцины, но пока ни одна из них не прошла фазу испытаний I.
Влияние среды до вакцинации на реакцию на вакцину
Микросреда до вакцинации плохо изучена для разработки вакцины. Существуют известные и, как правило, хорошо изученные факторы, которые влияют на ответ на вакцину, включая возраст, пол, генетическое происхождение, различия в физической среде и ранее существовавший иммунитет.Например, в одном исследовании сравнивали реакцию на лицензированную вакцину против желтой лихорадки YF-17D у здоровых взрослых людей разного происхождения и пола. Результаты показывают, что у мужчин смешанного европейского происхождения уровень антител выше по сравнению с женщинами того же происхождения, лицами африканского происхождения или выходцами из Латинской Америки (65). Недавно исследователи из Оксфорда опубликовали исследование, в котором излагается, как генетическая изменчивость может повлиять на реакцию на вакцину и сохранение иммунитета после детских прививок.Они подробно описывают значительную вариабельность величины и устойчивости иммунитета, индуцированного вакциной, из-за генетических факторов, с использованием полногеномного исследования ассоциации (GWAS) в детских капсульных вакцинах группы C от менингококка (MenC), Hemophilus influenzae типа b и столбнячного анатоксина (TT ) вакцина. При этом они смогли определить ассоциации между однонуклеотидными полиморфизмами (SNP) в локусе человеческого лейкоцитарного антигена (HLA) и устойчивостью иммунитета (66). Было также показано, что старение играет важную роль в ответе на вакцину.Например, в двух крупномасштабных клинических испытаниях сравнивали иммуногенность высокоэффективной вакцины против желтой лихорадки YF-17D у взрослых и пожилых людей. В одном исследовании не было обнаружено разницы между генерацией нейтрализующих антител между двумя группами, но в другом исследовании было обнаружено, что у пожилой когорты наблюдалась отсроченная реакция антител и более высокая виремия (67).
Предсуществующий иммунитет или «изначальный антигенный грех» — хорошо известный барьер на пути к продуктивной вакцине, особенно для флавивирусов, которые все антигенно связаны.Это явление может модулировать иммунный ответ на последовательные инфекции или вакцинации. В общем, иммунная память о перекрестно-реактивных антигенных сайтах и образование иммунных комплексов могут влиять на ответы антител при любых последовательных инфекциях или иммунизациях схожими антигенами. Это было показано в недавней статье 2019 года, в которой ранее существовавший иммунитет к желтой лихорадке от инфекции ослаблял реакцию антител на вакцинацию против клещевого энцефалита (68). Важно учитывать эту перспективу, особенно при разработке вакцины против денге.
Тем не менее, микросреда до вакцинации, например уровни воспаления и иммунной активации, которые уже активны у человека, имеет большое влияние на то, как пациент будет реагировать на конкретную вакцину. В исследовании, опубликованном в 2014 году, исследователи изучили среду до вакцинации и реакцию на вакцины между участниками исследования из Энтеббе, Уганда или Лозанны, Швейцария, которые были вакцинированы против желтой лихорадки лицензированной вакциной против желтой лихорадки YF-17D.Они обнаружили фундаментальные различия в последующих клеточных или гуморальных ответах после вакцинации, включая существенно более низкий уровень CD8 + Т-лимфоцитов и В-клеток из когорты Энтеббе по сравнению с иммунизированными людьми из Лозанны, что означает ослабленный ответ на вакцину. Исследователи также наблюдали более высокую частоту дифференцированных субпопуляций Т- и В-клеток, истощенных и активированных NK-клеток и провоспалительных моноцитов, предполагая, что активированное иммунное микроокружение в когорте Энтеббе до вакцинации привело к различиям в ответах на вакцинацию.Активация провоспалительных моноцитов на исходном уровне привела к отрицательной корреляции с титрами нейтрализующих антител YF-1D после вакцинации (69). Хотя нам известно, что старение играет роль в том, как субъект будет реагировать на вакцинацию, только недавно были исследованы механизмы. В 2015 году исследователи сообщили, что воспаление перед вакцинацией и притупление сигналов В-клеток из-за старения коррелируют с гипореактивностью на вакцинацию против гепатита В (ВГВ) (70). В частности, с помощью транскрипционного и цитометрического профилирования цельной крови, собранной перед вакцинацией, они показывают, что наблюдается увеличение количества транскриптов воспалительного ответа и провоспалительных моноцитов в более старшей когорте, что коррелирует со слабым ответом вакцины на вакцину против HBV.И наоборот, усиленные ответы В-клеток и более высокая частота В-клеток коррелировали с более сильным ответом на вакцину у более молодых людей. Это исследование было первым, в котором были определены исходные реакции, которые могут предсказать ответы на вакцину против ВГВ и, возможно, на другие вакцины. Следовательно, при разработке любой вакцины необходимо учитывать наличие предвакцинного иммунного микроокружения.
Проблемы, стоящие перед разработкой вакцины против денге
Антитело-зависимое усиление (ADE)
В отличие от других высокоэффективных вакцин, разработанных против других флавивирусов, разработка вакцины против денге является очень сложной задачей из-за того факта, что вирус имеет четыре антигенно различных серотипа (DENV1–4).Для получения идеальной вакцины против денге вакцина должна быть эффективной против всех четырех серотипов одновременно. Первичные инфекции DENV обычно протекают бессимптомно или с легкими гриппоподобными симптомами (рис. 4A). После инфицирования DENV антитела развиваются примерно через 1 неделю. Во время первичного инфицирования одним серотипом DENV антитела, продуцируемые этим серотипом, обычно приводят к длительной защите от этого конкретного серотипа и краткосрочной защите от других серотипов (5). Антитела играют двойную роль в борьбе с инфекцией DENV, при которой они могут нейтрализовать или усилить проникновение вируса (4).Исследование, в котором анализировались антитела, вырабатываемые при пост-первичной инфекции DENV у человека, обнаружило низкие количества высокоспецифичных и нейтрализующих антител, которые были в основном против домена EDIII оболочки. С другой стороны, они обнаружили, что наиболее слабые перекрестно-реактивные антитела были против prM (71). Существующие ранее нейтрализующие антитела могут предотвратить прикрепление DENV к его естественному рецептору на поверхности клетки, тем самым подавляя проникновение вируса (рис. 4B). Однако антитела от гетерологичной инфекции могут быть перекрестно-реактивными и способствовать процессу, известному как антитело-зависимое усиление или ADE.Этот механизм позволяет вирусу проникать в эндосому и выходить из нее, а также проходить путь, аналогичный первичному пути заражения, вызывая более высокую вирусную нагрузку и, в конечном итоге, усиливая болезнь (5, 72). ADE наблюдалась в отношении различных вирусов, включая ВИЧ, Эбола и, возможно, вирус, ответственный за недавнюю пандемию, SARS-CoV2. Fc-рецептор (FcR) -зависимая ADE считается наиболее распространенным механизмом ADE среди многих вирусов, включая денге, ВИЧ и грипп A. Комплексы вирус-антитело будут связываться с клетками, которые имеют FcR, такие как макрофаги, моноциты, B-клетки, и нейтрофилы за счет взаимодействия между Fc-частью антитела и FcR на поверхности клетки.По сути, это создает иммунный синапс, который увеличивает прикрепление вирусов к клеткам (73) (рис. 4C). Другой возможный механизм ADE включает активацию классического пути комплемента. В то время как FcR экспрессируются только на иммунных клетках, рецепторы комплемента (CR) широко экспрессируются на большинстве клеток (74). Например, ADE ВИЧ может происходить через FcR или комплексы вирус-фрагмент C3 и классические CR, которые будут способствовать нормальному проникновению вируса через вирусный поверхностный белок gp120 и его рецепторы и корецепторы (75).Кроме того, Эбола использует другой механизм ADE, опосредованный комплементом, при котором антитела связываются в непосредственной близости, позволяя C1q связываться с частью Fc антител. Этот комплекс (вирус, антитела и C1q) связывается с рецепторами C1q (C1qR), что способствует либо эндоцитозу, либо связыванию вируса со специфическими рецепторами вируса Эбола (74, 76). Недавно Ван и соавт. опубликовал механизм ADE в коронавирусах. Их результаты показывают, что ADE коронавирусов может опосредоваться нейтрализующими антителами, которые нацелены на рецептор-связывающие домены шипов коронавируса.Интересно и то, что в отличие от денге, которая включает ADE с разными серотипами, одни и те же штаммы коронавируса, которые продуцируют полностью нейтрализующие антитела, могут опосредованно проходить ADE с помощью одних и тех же нейтрализующих антител (77). Также неясно, требуются ли вирус-специфические рецепторы для входа в ADE. Это может зависеть от того, имеет ли вирус оболочку или нет, и механизма ADE, но если вирус полагается на поверхностные рецепторы только для связывания, вирус может быть способен инфицировать клетки через FcR без естественного рецептора.Это моделирует, как нечувствительные клетки, которые не экспрессируют естественный рецептор вируса, могут быть инфицированы, когда FcR экспрессируется так же, как FcR-опосредованная ADE ящура (78).
Рисунок 4 . Антитело-зависимое усиление (ADE): (A) Первичная инфекция без предварительной вакцинации. DENV войдет в макрофаги через свой родственный рецептор; однако в большинстве случаев это приводит к легкому заболеванию, а иногда даже может быть симптоматическим или с легкими симптомами, похожими на грипп. (B) DENV в присутствии нейтрализующих антител того же серотипа. DENV не сможет проникнуть в клетки и установить инфекцию. (C) Перекрестно-реактивные антитела от предыдущей неудачной вакцины против денге или инфекции денге с разными серотипами будут связывать, но не нейтрализовать вирус. Это низкоаффинное связывание будет способствовать проникновению вируса в макрофаг через рецептор FC, что приводит к усилению виремии, ведущей к ADE.
Причина большого количества инфицированных клеток и высоких вирусных частиц после ADE была показана в исследовании, в котором DENV-иммунные комплексы могут подавлять противовирусный иммунный ответ путем подавления продукции IL-12, TNF-a, IFN- γ и радикалы оксида азота (NO) и усиливают экспрессию IL-6 и IL-10, тем самым способствуя продукции вирусных частиц (79).ADE возникает у людей, инфицированных денге, которые ранее были инфицированы серотипом, отличным от первого того или иного флавивируса. ADE также может возникнуть при плохой реакции на вакцинацию. Было показано, что как анти-E, так и анти-prM антитела усиливают проникновение DENV в клетки-мишени через Fc γ — опосредованную ADE (4). Исследование, опубликованное в 2010 году, показало, что ответ на перекрестно-реактивные эпитопы, такие как prM, может быть частью механизма уклонения иммунитета от DENV. Кроме того, они посоветовали снизить ответ против PRM при разработке вакцины против денге, чтобы уменьшить ADE (80).Одним из примеров вакцины-кандидата DENV, который отказался от PRM, является доклиническая вакцина. Эта вакцина на основе VLP разработана для выработки антител против домена EDIII и продемонстрировала снижение ADE на животных моделях (62). Кроме того, недавнее исследование, проведенное в 2019 году с использованием молекулярного моделирования, показало, что более высокие перекрестно-реактивные антитела к DENV связаны с более высоким уровнем ADE, и что слабоиммуногенная вакцина усиливает ADE (81). В конечном итоге ADE является основным причинным фактором прогрессирования самоограничивающейся лихорадки денге до DHF и DSS (4, 82–84) (рис. 4).
Перекрестная реактивность с другими флавивирусами
Есть несколько проблем, которые препятствовали разработке вакцины против денге. Одной из этих проблем является структурное сходство между DENV и другими членами вирусов семейства Flaviviridae, такими как вирус Зика (ZIKV), вирус желтой лихорадки (YFV), вирус японского энцефалита (JEV) и вирус Западного Нила (WNV). Белок оболочки (E) является как структурно консервативным среди флавивирусов, так и наиболее подверженным воздействию белка, против которого иммунная система вырабатывает антитела, чтобы нейтрализовать вирус.Белок E состоит из трех функционально и структурно различных доменов EDI, EDII и EDIII (85). Белок оболочки (E) DENV имеет более чем 50% гомологию с белком ZIKV E, что приводит к перекрестной реактивности (86). Перекрестная реактивность способствует либо защите, либо патогенному усилению второй инфекции с одним из членов, в зависимости от количества и специфичности генерируемых антител. В 2016 г. вспышки ZIKV охватили регионы, эндемичные для DENV, на севере Бразилии и Мексики (85, 87).Следовательно, люди, инфицированные ZIKV, скорее всего, предварительно подверглись воздействию DENV, и наоборот. Это вызвало обеспокоенность у исследователей, поскольку ранее существовавший иммунитет к другим флавивирусам влияет на иммунные ответы, вызванные DENV, что может привести к тяжелым проявлениям денге.
Исследования показывают, что как гуморальный, так и клеточный иммунитет вносят вклад в патогенез заболевания, причем гуморальный иммунитет является основным причинным фактором ADE. Однако было обнаружено, что высокие концентрации уже существующих перекрестно-реактивных антител способны снижать вероятность симптоматических инфекций денге (88).Следовательно, должен быть достигнут порог концентрации перекрестно-реактивных антител, чтобы эффективно нейтрализовать и ингибировать прикрепление и проникновение вируса. С другой стороны, если титры перекрестно-реактивных антител не достигают порогового значения, возникает ADE, и нейтрализация не выполняется. Одно недавнее исследование, проведенное среди населения Мексики, определило ответ перекрестно-реагирующих антител в сыворотке пациентов с DENV на рекомбинантный белок оболочки ZIKV (85). Они продемонстрировали, что образцы сыворотки пациентов, инфицированных денге, содержат перекрестно-реактивные антитела против белка E ZIKV, которые могут либо опосредовать ADE, либо нейтрализовать инфекцию в зависимости от концентрации антител (85).Было замечено, что защита от тяжелых инфекций длится в течение 2 лет после первичной инфекции, после чего нейтрализующие антитела распадаются и риск симптоматической и тяжелой инфекции денге увеличивается при вторичной гетерологичной инфекции (88). Есть некоторые свидетельства того, что одновременное повторное воздействие необходимо для поддержания перекрестно-реактивных нейтрализующих антител в течение более длительного времени (89). Большинство эффективных вакцин обеспечивают защиту от патогенов, генерируя нейтрализующие антитела.Долгоживущие плазматические клетки, секретирующие антитела, продуцируются зародышевыми центрами (GC), которые образуются во вторичных лимфоидных тканях с помощью T-фолликулярных клеток-помощников (Tfh) (90). Использование этого механизма для плазматических клеток, секретирующих долгоживущие антитела, жизненно важно для создания полностью эффективной вакцины против лихорадки денге.
Нацеливание на клетки Tfh для повышения эффективности вакцины против денге
Ответы зародышевого центра (GC) поддерживаются специализированным типом CD4 + Т-клеток, называемым Tfh-клетками. Tfh в основном расположены в GC, однако аналоги этих клеток присутствуют в периферической крови, что можно идентифицировать по экспрессии CXCR5, ICOS и PD-1 (91, 92).Растет интерес к изучению Tfh (cTfh) в циркулирующей периферической крови вместо GC Tfh и их использованию в качестве биомаркеров активности GC, поскольку сбор здоровой лимфоидной ткани человека может быть более трудным, чем сбор периферической крови (93, 94). Клетки CTfh бывают разных подтипов, каждый из которых экспрессирует разные цитокины и, следовательно, имеет разные способности оказывать помощь В-клеткам (95, 96). CTfh2 в основном считается неэффективным помощником, в то время как cTfh3 и cTfh27 — эффективными подтипами помощника.Кроме того, эти клетки сильно коррелировали с широко нейтрализующими антителами (95, 97). Эти клетки cTfh являются отличным инструментом для мониторинга ответов на вакцины. Как правило, Tfh активирует GC B-клетки, продуцируя IL-21 и активируя различные белки и факторы транскрипции, такие как ICOS, Bcl-6, PD-1 и CD40 (98). Активированные антигеном В-клетки мигрируют в фолликул В-клеток во вторичной лимфатической ткани, где они дифференцируются, пролиферируют и претерпевают посредством переключения классов, гипермутации соматических генов (ГСМ) и созревания аффинности.B-клетки, которые прошли через SHM, выходят из цикла деления, чтобы проверить свой недавно мутировавший рецептор B-клеток, взаимодействуя с антигенами, экспрессируемыми фолликулярными дендритными клетками (FDC) антигенпрезентирующих клеток. Наконец, B-клетки должны пройти процесс отбора, чтобы выйти из GC в виде долгоживущих плазматических клеток и прочных клеток памяти. Процесс отбора происходит путем представления обработанного антигена на В-клетках клеткам Tfh для отбора В-клеток с более высоким сродством к патогену (98). Недавнее исследование показало повышенную активацию клеток Tfh в критической фазе болезни по сравнению с легкой и умеренной фазой болезни, которая сильно коррелировала с высокой частотой плазменных бластов.Кроме того, количество активированных периферических Tfh при вторичных инфекциях DENV увеличивается по сравнению с первичными инфекциями DENV (99). Это может быть связано с активацией клеток Tfh, специфичных только для одного серотипа, что приводит к патогенезу ADE и заболевания. Однако мы предполагаем, что увеличение количества клеток Tfh, специфичных для всех серотипов, может решить проблему ADE. В конце концов, клетки Tfh поддерживают ответ GC и положительно регулируют величину ответа GC. Было показано, что использование аденозиндезаминазы-1 (ADA-1) в качестве адъюванта является одной из потенциальных стратегий модификации и усиления функции Tfh.ADA-1 — это внутриклеточный фермент, который превращает аденозин в инозин в процессе дезаминирования. ADA-1 также участвует в развитии и поддержании иммунной системы, усиливая дифференцировку наивных Т-клеток в эффекторные, регуляторные и Т-клетки памяти CD4 + (100). Он играет центральную роль в иммунной системе, поскольку мутация ADA-1 приводит к тяжелым иммунологическим нарушениям и потере функциональных T, B и NK-клеток (101). Одно исследование с использованием PBMC и клеток миндалин от ВИЧ-инфицированных пациентов показывает, что ADA-1 необходим для эффективного ответа GC-Tfh и способствует созреванию аффинности антител в GC, обеспечивая благоприятное микроокружение цитокинов (102).Многие исследования показали сильную корреляцию между эффективной индукцией В-клеток памяти и плазматических клеток, которые будут продуцировать специфические нейтрализующие антитела против гриппа и лихорадки Эбола, и увеличением количества клеток Tfh в контексте иммунизации (93, 97, 103). Для разработки будущей вакцины важно определить потенциальные адъюванты, которые будут эффективно нацеливать и индуцировать ответ Tfh. Большинство вакцин зависят от адъювантов для улучшения иммунного ответа, повышения титров нейтрализующих антител, индукции длительного иммунитета и снижения требуемых доз вакцины.В контексте индукции Tfh было показано, что адъюванты вода в масле избирательно способствуют ответу Tfh, такие как неполный адъювант Фрейнда (IFA), Montanide ISA 720 и ISA-51 (104). Другое исследование показало, что адъювант MF59 «масло в воде» опосредует мощный ответ Tfh, который напрямую способствует ответам GC (105). Другие адъюванты, такие как агонисты TLR4, TLR6, TLR7, TLR8 и TLR9, проявили большой интерес к использованию адъювантов вакцины, поскольку агонисты TLR могут усиливать клетки Tfh (106). Клетки Tfh должны быть избирательно и эффективно усилены, чтобы преодолеть серонегативную группу неудач при вакцинации против денге, чтобы добиться специфичности ко всем 4 серотипам одновременно с использованием мощного адъюванта, такого как ADA (рис. 5).С другой стороны, повышение активности Tfh было связано с множеством аутоиммунных заболеваний, таких как системная красная волчанка (СКВ), ревматоидный артрит (РА) и рассеянный склероз (РС) (107–110). В заключение, клетки Tfh — это палка о двух концах, и временное усиление их активности было бы полезным для разработки точной вакцины против денге, которая генерировала бы нейтрализующие титры антител ко всем серотипам денге независимо от серологического статуса вакцины.
Рисунок 5 .Улучшение вакцины против денге путем нацеливания на клетки Tfh для преодоления серостатического эффекта денге: (A) Введение вакцины против денге наивному человеку с адъювантом Tfh (ADA) будет осуществляться DC, который перемещается в LN и вызывает усиление клеток Tfh-B взаимодействие. Усиленное взаимодействие индуцирует Tfh-специфические клетки к четырем серотипам денге, что приводит к дифференцировке В-клеток памяти и плазмобластов, которые продуцируют высокоаффинные нейтрализующие антитела против всех серотипов, которые нейтрализуют вирус денге. (B) Введение вакцины против денге наивным людям без адъюванта Tfh (ADA). Вакцина будет поглощена DC, который будет перемещаться в LN и индуцировать взаимодействие клеток Tfh-B в среде. Взаимодействие со средой приведет к образованию Tfh, B-клеток и плазмобластов, специфичных для некоторых серотипов денге. Антитела, продуцируемые этим ответом, сделают их уязвимыми к ADE и усиленным заболеваниям денге при заражении вирусом другого серотипа денге, против которого у них есть субнейтрализующие антитела.
Сводка
DENV представляет собой серьезную проблему для здоровья, и необходима разработка наилучшей вакцины, чтобы уменьшить бремя этого заболевания для общества. Денге — очень сложный и сложный вирус, потому что он имеет четыре отдельных серотипа денге. Это означает, что для создания эффективной вакцины против денге она должна индуцировать нейтрализующие высокоаффинные антитела к 4 серотипам одновременно, чтобы избежать ADE. На данный момент единственная лицензированная вакцина против денге Dengvaxia (CYD-TDV), разработанная Санофи Пастер, преподала нам важный урок о том, что серостатус денге влияет на реакцию на вакцину.В случае Dengvaxia люди, не инфицированные лихорадкой денге, не реагировали на вакцину должным образом по сравнению с людьми с иммунитетом. Это различие между двумя группами необходимо исследовать на уровне микросреды перед вакцинацией, чтобы решить эту проблему. Однако мы предполагаем, что низкая активация клеток Tfh, специфичная для каждого из четырех серотипов, является фундаментальным различием между двумя группами. Эта проблема может быть решена путем добавления адъювантов, таких как ADA, которые сильно активируют клетки Tfh и вызывают специфические особенности Tfh для 4 серотипов вируса.Мы считаем, что это может заставить наивных людей отреагировать на вакцину и вызвать образование высокоаффинных нейтрализующих антител ко всем 4 серотипам и заставить их реагировать так же, как и людей, вакцинированных против лихорадки денге.
Авторские взносы
SanA, SawA и JC внесли свой вклад в написание разделов статьи и дизайна рисунков. EH и AI внесли свой вклад в концепцию, структуру и написание статьи. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Эта работа была поддержана финансированием NIH в рамках Консорциума проекта по иммунитету человека (HIPC) для EH # U19 AI128910 и AI125202. Рисунки созданы с помощью biorender.com.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы хотели бы поблагодарить Университет короля Абдель Азиза и его программу стипендий за их поддержку.
Список литературы
2. Харихаран Д., Дас М.К., Шепард Д.С., Арора Н.К. Экономическое бремя болезни денге в Индии с 2013 по 2016 год: систематический анализ. Int J Infect Dis. (2019) 84S: S68–73. DOI: 10.1016 / j.ijid.2019.01.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Хуанг К.Дж., Ян Ю.К., Лин Ю.С., Хуанг Дж.Х., Лю Х.С., Йе Т.М. и др. Двойное специфическое связывание вируса денге и клеток-мишеней для антителозависимого усиления инфекции вирусом денге. J Immunol. (2006) 176: 2825–32. DOI: 10.4049 / jimmunol.176.5.2825
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Rodenhuis-Zybert IA, Wilschut J, Smit JM. Жизненный цикл вируса денге: факторы вируса и хозяина, модулирующие инфекционность. Cell Mol Life Sci. (2010) 67: 2773–86. DOI: 10.1007 / s00018-010-0357-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Tremblay N, Freppel W, Sow AA, Chatel-Chaix L.Взаимодействие между вирусом денге и врожденной иммунной системой человека: игра в прятки. Вакцины. (2019) 7: 145. DOI: 10.3390 / Vacines7040145
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Chong HY, Leow CY, Bakar AMA, Leow CH. Инфекция флавивирусом — обзор иммунопатогенеза, иммунологического ответа и иммунодиагностики. Virus Res. (2019) 274: 197770. DOI: 10.1016 / j.virusres.2019.197770
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12.Родригес-Барракер I, Майер-и-Теран-Ромеро Л., Шварц И.Б., Берк Д.С., Каммингс Д.А. Потенциальные возможности и опасности несовершенных вакцин против денге. Вакцина. (2014) 32: 514–20. DOI: 10.1016 / j.vaccine.2013.11.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Зиберт И.А., ван дер Энде-Мецелаар Х., Вильшут Дж., Смит Дж. М.. Функциональное значение созревания вируса денге: инфекционные свойства незрелых вирионов. J Gen Virol. (2008) 89: 3047–51.DOI: 10.1099 / vir.0.2008 / 002535-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Паранавитане С.А., Гомес Л., Камаладаса А., Адикари Т.Н., Викрамасингх Н., Дживандара С. и др. Антиген NS1 денге как маркер тяжелого клинического заболевания. BMC Infect Dis. (2014) 14: 570. DOI: 10.1186 / s12879-014-0570-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Chao CH, Wu WC, Lai YC, Tsai PJ, Perng GC, Lin YS, et al. Неструктурный белок 1 вируса денге активирует тромбоциты через Toll-подобный рецептор 4, что приводит к тромбоцитопении и кровотечению. PLoS Pathog. (2019) 15: e1007625. DOI: 10.1371 / journal.ppat.1007625
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Хо Л.Дж., Ван Дж.Дж., Шайо М.Ф., Као С.Л., Чанг Д.М., Хан С.В. и др. Заражение дендритных клеток человека вирусом денге вызывает созревание клеток и выработку цитокинов. J Immunol. (2001) 166: 1499–506. DOI: 10.4049 / jimmunol.166.3.1499
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Ho LJ, Hung LF, Weng CY, Wu WL, Chou P, Lin YL, et al.Вирус денге 2 типа противодействует противовирусному действию IFN-α, но не IFN-γ, посредством подавления передачи сигналов Tyk2-STAT в дендритных клетках человека. J Immunol. (2005) 174: 8163–72. DOI: 10.4049 / jimmunol.174.12.8163
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Агирре С., Маэстре А.М., Пагни С., Патель Дж. Р., Сэвидж Т., Гутман Д. и др. DENV подавляет продукцию IFN типа I в инфицированных клетках путем расщепления STING человека. PLoS Pathog. (2012) 8: e1002934. DOI: 10.1371 / journal.ppat.1002934
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Муньос-Йордан Дж. Л., Лоран-Ролль М., Ашур Дж., Мартинес-Собридо Л., Ашок М., Липкин В. И. и др. Ингибирование передачи сигналов альфа / бета-интерферона белком NS4B флавивирусов. J Virol. (2005) 79: 8004–13. DOI: 10.1128 / JVI.79.13.8004-8013.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Насирудин А., Вонг Х. Х., Тхиен П., Сюй С., Лам К. П., Лю Д. Х.RIG-I, MDA5 и TLR3 синергетически играют важную роль в ограничении инфицирования вирусом денге. PLoS Negl Trop Dis. (2011) 5: e926. DOI: 10.1371 / journal.pntd.0000926
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Лю Х.М., Лоо Ю.М., Хорнер С.М., Зорнецер Г.А., Катце М.Г., Гейл М. мл. Шаперон 14–3-3ε, направленный на митохондрии, регулирует транслокон RIG-I, который опосредует мембранную ассоциацию и врожденный противовирусный иммунитет. Клеточный микроб-хозяин. (2012) 11: 528–37. DOI: 10.1016 / j.chom.2012.04.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. He Z, Zhu X, Wen W, Yuan J, Hu Y, Chen J, et al. Вирус денге подрывает врожденный иммунитет хозяина, воздействуя на адаптерный белок MAVS. J Virol. (2016) 90: 7219–30. DOI: 10.1128 / JVI.00221-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Schnettler E, Sterken MG, Leung JY, Metz SW, Geertsema C, Goldbach RW, et al.Некодирующая РНК флавивируса проявляет активность супрессора РНК-интерференции в клетках насекомых и млекопитающих. J Virol. (2012) 86: 13486–500. DOI: 10.1128 / JVI.01104-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Какумани П.К., Пония С.С., Суд В., Чиннаппан М., Банерджа А.С., Медигеши Г.Р. и др. Роль РНК-интерференции (РНКи) в репликации вируса денге и идентификация NS4B как супрессора РНКи. J Virol. (2013) 87: 8870–83. DOI: 10.1128 / JVI.02774-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Шах П.С., Линк Н., Джанг Г.М., Шарп П.П., Чжу Т., Свани Д.Л. и др. Сравнительное картирование взаимодействия флавивируса и белка-хозяина раскрывает механизмы патогенеза вируса денге и вируса Зика. Cell. (2018) 175: 1931–45.e18. DOI: 10.1016 / j.cell.2018.11.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Джон ALS, Rathore AP, Yap H, Ng ML, Metcalfe DD, Vasudevan SG, et al.Иммунный надзор с помощью тучных клеток во время инфекции денге способствует привлечению естественных киллеров (NK) и NKT-клеток и уничтожению вирусов. Proc Natl Acad Sci USA. (2011) 108: 9190–5. DOI: 10.1073 / pnas.1105079108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Мэтью А., Курейн И., Ротман А.Л., Зенг Л.Л., Бринтон М.А., Эннис Ф.А. Доминирующее распознавание CD8 + цитотоксическими Т-лимфоцитами человека неструктурных белков NS3 и NS1 вируса денге. 2а. J Clin Invest. (1996) 98: 1684–91. DOI: 10.1172 / JCI118964
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Симон-Лорьер Э, Дуонг В., Тауфик А., Унг С., Ли С., Касадемонт I и др. Повышенные адаптивные иммунные реакции и правильная регуляция обратной связи защищают от клинической денге. Sci Transl Med. (2017) 9: eaal5088. DOI: 10.1126 / scitranslmed.aal5088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Mongkolsapaya J, Dejnirattisai W., Xu XN, Vasanawathana S, Tangthawornchaikul N, Chairunsri A, et al.Оригинальный антигенный грех и апоптоз в патогенезе геморрагической лихорадки денге. Nat Med. (2003) 9: 921–7. DOI: 10,1038 / нм887
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Киркпатрик Б.Д., Уайтхед С.С., Пирс К.К., Тайбери С.М., Гриер П.Л., Хайнс Н.А. и др. Живая аттенуированная вакцина против денге TV003 обеспечивает полную защиту от денге на модели заражения человека. Sci Transl Med. (2016) 8: 330ra36. DOI: 10.1126 / scitranslmed.aaf1517
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32.Шривастава А., Трипати Н.К., Даш П.К., Парида М. Работа над лихорадкой денге как болезнью, которую можно предотвратить с помощью вакцин: проблемы и возможности. Exp Opin Biol Ther. (2017) 17: 1193–9. DOI: 10.1080 / 14712598.2017.1356284
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. ВОЗ. Всемирная организация здравоохранения. Международные путешествия и здоровье — Глава 6. Болезни и вакцины, предупреждаемые с помощью вакцин. (2017). Доступно в Интернете по адресу: http://www.who.int/ith/en/ (по состоянию на 4 июня 2020 г.).
Google Scholar
35. Томас С.Дж., Юн И.К. Обзор Dengvaxia (R): от разработки до развертывания. Hum Vaccin Immunother. (2019) 15: 2295–314. DOI: 10.1080 / 21645515.2019.1658503
CrossRef Полный текст | Google Scholar
36. Доригатти И., Агуас Р., Доннелли, Калифорния, Гай Б., Кудевиль Л., Джексон Н. и др. Моделирование иммунологического ответа на четырехвалентную вакцину против лихорадки денге по результатам нескольких испытаний фазы 2 в Латинской Америке и Юго-Восточной Азии. Вакцина. (2015) 33: 3746–51. DOI: 10.1016 / j.vaccine.2015.05.059
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Гай Б., Бриан О., Ланг Дж., Сэвилл М., Джексон Н. Разработка четырехвалентной вакцины против денге Санофи Пастер: еще один шаг вперед. Вакцина. (2015) 33: 7100–11. DOI: 10.1016 / j.vaccine.2015.09.108
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Шридхар С., Людтке А., Ланжевен Э., Чжу М., Бонапарт М., Махаберт Т. и др.Влияние серологического статуса денге на безопасность и эффективность вакцины против денге. N Engl J Med. (2018) 379: 327–40. DOI: 10.1056 / NEJMoa1800820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Уайтхед С.С., Дарбин А.П., Пирс К.К., Элвуд Д., МакЭлвани Б.Д., Фрейзер Е.А. и др. В рандомизированном исследовании живая аттенуированная четырехвалентная вакцина против денге TV003 хорошо переносилась и обладала высокой иммуногенностью у субъектов, подвергшихся воздействию флавивируса до вакцинации. PLoS Negl Trop Dis. (2017) 11: e0005584. DOI: 10.1371 / journal.pntd.0005584
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Саэс-Льоренс X, Трику В., Ю. Д., Ривера Л., Тубой С., Гарбес П. и др. Безопасность и иммуногенность одной против двух доз четырехвалентной вакцины против денге компании Takeda у детей в Азии и Латинской Америке: промежуточные результаты фазы 2 рандомизированного плацебо-контролируемого исследования. Lancet Infect Dis. (2017) 17: 615–25. DOI: 10.1016 / S1473-3099 (17) 30166-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41.Бауэр К., Эсквилин И.О., Корниер А.С., Томас С.Дж., дель Рио AIQ, Бертран-Пасарелл Дж. И др. Фаза II, рандомизированное исследование безопасности и иммуногенности полученной на основе живой аттенуированной вакцины против вируса денге у здоровых детей и взрослых, проживающих в Пуэрто-Рико. Am J Trop Med Hyg. (2015) 93: 441–53. DOI: 10.4269 / ajtmh.14-0625
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Schmidt AC, Lin L, Martinez LJ, Ruck RC, Eckels KH, Collard A, et al. Фаза 1 рандомизированного исследования четырехвалентной очищенной инактивированной вакцины против денге у здоровых взрослых в США. Am J Trop Med Hyg. (2017) 96: 1325–37. DOI: 10.4269 / ajtmh.16-0634
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Беккет К.Г., Тьяден Дж., Берджесс Т., Данко Дж. Р., Тамминга С., Симмонс М. и др. Оценка прототипа ДНК-вакцины против лихорадки денге-1 в фазе 1 клинических испытаний. Вакцина. (2011) 29: 960–8. DOI: 10.1016 / j.vaccine.2010.11.050
CrossRef Полный текст | Google Scholar
44. Киркпатрик Б.Д., Дурбин А.П., Пирс К.К., Кармолли М.П., Тайбери С.М., Гриер П.Л. и др.Устойчивый и сбалансированный иммунный ответ на все 4 серотипа вируса денге после введения одной дозы живой аттенуированной четырехвалентной вакцины против денге здоровым взрослым, не инфицированным флавивирусом. J Infect Dis. (2015) 212: 702–10. DOI: 10.1093 / infdis / jiv082
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Osorio JE, Partidos CD, Wallace D, Stinchcomb DT. Разработка рекомбинантной химерной четырехвалентной вакцины-кандидата от денге. Вакцина. (2015) 33: 7112–20. DOI: 10.1016 / j.vaccine.2015.11.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Брюу Дж. Н., Кинни Р. М., Пауэлл Т. Д., Аргуэлло Дж. Дж., Силенго С. Дж., Партидос С. Д. и др. Иммуногенность и эффективность составов химерной вакцины против денге (DENVax) у мышей AG129 с дефицитом интерферона. Вакцина. (2012) 30: 1513–20. DOI: 10.1016 / j.vaccine.2011.11.072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47.Осорио Дж. Э., Хуанг CY-H, Кинни Р. М., Стинчкомб Д. Т.. Разработка DENVax: химерной четырехвалентной вакцины на основе PDK-53 на основе денге-2 для защиты от лихорадки денге. Вакцина. (2011) 29: 7251–60. DOI: 10.1016 / j.vaccine.2011.07.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Томас С.Дж., Экелс К.Х., Карлетти И., Де ла Баррера Р., Десси Ф., Фернандес С. и др. Фаза II, рандомизированное исследование безопасности и иммуногенности репродуктивной живой аттенуированной вакцины против вируса денге у здоровых взрослых. Am J Trop Med Hyg. (2013) 88: 73–88. DOI: 10.4269 / ajtmh.2012.12-0361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Фернандес С., Томас С.Дж., Де Ла Баррера Р., Им-Эрбсин Р., Джарман Р.Г., Барас Б. и др. Адъювантный четырехвалентный очищенный от вируса денге инактивированный кандидат в вакцину индуцирует длительные и защитные реакции антител против заражения денге у макак-резусов. Am J Trop Med Hyg. (2015) 92: 698–708. DOI: 10.4269 / ajtmh.14-0268
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Flingai S, Czerwonko M, Goodman J, Kudchodkar S, Muthumani K, Weiner D. Синтетические ДНК-вакцины: улучшенная эффективность вакцины путем электропорации и совместной доставки генетических адъювантов. Front Immunol. (2013) 4: 354. DOI: 10.3389 / fimmu.2013.00354
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Манофф С.Б., Джордж С.Л., Бетт А.Дж., Йелмене М.Л., Дханасекаран Г., Эггемейер Л. и др.Доклиническая и клиническая разработка рекомбинантной субъединичной вакцины против денге. Вакцина. (2015) 33: 7126–34. DOI: 10.1016 / j.vaccine.2015.09.101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. Клементс Д.Е., Коллер Б.-АГ, Либерман М.М., Огата С., Ван Г., Харада К.Э. и др. Разработка рекомбинантной четырехвалентной вакцины против вируса денге: исследования иммуногенности и эффективности на мышах и обезьянах. Вакцина. (2010) 28: 2705–15. DOI: 10.1016 / j.vaccine.2010.01.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Говиндараджан Д., Мешино С., Гуан Л., Клементс Д. Э., тер Меулен Дж. Х., Казимиро Д. Р. и др. Доклиническая разработка четырехвалентной рекомбинантной субъединичной вакцины денге: иммуногенность и защитная эффективность у нечеловеческих приматов. Вакцина. (2015) 33: 4105–16. DOI: 10.1016 / j.vaccine.2015.06.067
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Манофф С.Б., Сауссер М., Фальк Рассел А., Мартин Дж., Рэдли Д., Хаятт Д. и др.Иммуногенность и безопасность исследуемой четырехвалентной рекомбинантной субъединичной вакцины от лихорадки денге: результаты рандомизированного клинического испытания фазы I у взрослых, не инфицированных флавивирусами. Hum Vaccin Immunother. (2019) 15: 2195–204. DOI: 10.1080 / 21645515.2018.1546523
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Brandler S, Ruffie C, Najburg V, Frenkiel MP, Bedouelle H, Desprès P и др. Детская противокоревая вакцина, экспрессирующая четырехвалентный антиген денге, вырабатывает нейтрализующие антитела против всех четырех вирусов денге. Вакцина. (2010) 28: 6730–9. DOI: 10.1016 / j.vaccine.2010.07.073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Harahap-Carrillo SI, Ceballos-Olvera I, Valle RJ. Иммуногенные субвирусные частицы, демонстрирующие домен III белка оболочки денге 2, управляемый вирусом кори. Вакцины. (2015) 3: 503–18. DOI: 10.3390 / Vacines3030503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. White LJ, Sariol CA, Mattocks MD, Wahala MPBW, Yingsiwaphat V, Collier ML, et al.Четырехвалентная вакцина против денге на основе альфавирусного вектора вызывает быстрый и защитный иммунный ответ у макак, который качественно отличается от иммунитета, вызванного инфекцией живого вируса. J Virol. (2013) 87: 3409. DOI: 10.1128 / JVI.02298-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Versiani AF, Astigarraga RG, Rocha ESO, Barboza APM, Kroon EG, Rachid MA, et al. Многослойные углеродные нанотрубки, функционализированные рекомбинантными белками оболочки вируса Денге 3, вызывают у мышей значительные и специфические иммунные ответы. J Nanobiotechnol. (2017) 15:26. DOI: 10.1186 / s12951-017-0259-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Chiang CY, Pan CH, Chen MY, Hsieh CH, Tsai JP, Liu HH, et al. Иммуногенность нового состава четырехвалентной вакцины с четырьмя рекомбинантными липидированными доменами III белка оболочки денге у мышей. Научный доклад (2016) 6: 30648. DOI: 10.1038 / srep30648
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61.Гил Л., Кобас К., Лазо Л., Маркос Е., Эрнандес Л., Сюзарте Е. и др. Четырехвалентный состав на основе рекомбинантных нуклеокапсидоподобных частиц вирусов денге вызывает функциональный иммунный ответ у мышей и обезьян. J Immunol. (2016) 197: 3597. DOI: 10.4049 / jimmunol.1600927
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Рамасами В., Арора У, Шукла Р., Поддар А., Шанмугам Р.К., Уайт Л.Дж. и др. Вакцина с четырехвалентными вирусоподобными частицами, разработанная для демонстрации домена III белков оболочки денге, индуцирует мультисеротипные нейтрализующие антитела у мышей и макак, которые обеспечивают защиту от антителозависимого усиления у мышей AG129. PLOS Negl Trop Dis. (2018) 12: e0006191. DOI: 10.1371 / journal.pntd.0006191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Шукла Р., Раджпут Р.К., Арора У., Поддар А., Сваминатан С., Ханна Н. Бивалентная вирусоподобная вакцина в виде частиц, экспрессируемая Pichia pastoris, индуцирует сфокусированные на домен III бивалентные нейтрализующие антитела без антителозависимого усиления in vivo . Front Microbiol. (2018) 8: 2644. DOI: 10.3389 / fmicb.2017.02644
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Ураками А., Нгве Тун М.М., Мой М.Л., Сакураи А., Исикава М., Куно С. и др. Вакцина из четырехвалентных частиц, подобных вирусу денге, с модифицированной оболочкой, имеет значение для разработки вакцины против флавивируса. J Virol. (2017) 91: e01181–17. DOI: 10.1128 / JVI.01181-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Монат Т.П., Четрон М.С., Маккарти К., Николс Р., Аршамбо В. Т., Велд Л. и др.Безопасность и иммуногенность вакцины против желтой лихорадки 17D для пожилых людей. Вакцины против человека. (2005) 1: 207–14. DOI: 10.4161 / hv.1.5.2221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. О’Коннор Д., Пнг Е, Хор С.К., Снейп, доктор медицины, Хилл А.В.С., ван дер Клис Ф. и др. Общие генетические вариации, связанные с сохранением иммунитета после иммунизации детей. Cell Rep. (2019) 27: 3241–53.e4. DOI: 10.1016 / j.celrep.2019.05.053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67.Roukens AH, Soonawala D, Joosten SA, de Visser AW, Jiang X, Dirksen K и др. Пожилые пациенты после вакцинации против желтой лихорадки имеют отсроченный ответ антител и длительную виремию: проспективное контролируемое когортное исследование. PLoS ONE. (2011) 6: e27753. DOI: 10.1371 / journal.pone.0027753
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Брэдт В., Малафа С., фон Браун А., Ярмер Дж., Цучникас Г., Медитс I и др. Существующий ранее иммунитет против желтой лихорадки ослабляет и модулирует реакцию антител на вакцинацию против клещевого энцефалита. Вакцины NPJ. (2019) 4:38. DOI: 10.1038 / s41541-019-0133-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Муянджа Э., Ссемаганда А., Нгаув П., Кубас Р., Перрин Х., Сринивасан Д. и др. Иммунная активация изменяет клеточные и гуморальные реакции на вакцину против желтой лихорадки 17D. J Clin Invest. (2014) 124: 3147–58. DOI: 10.1172 / JCI75429
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Фурати С., Кристеску Р., Лобода А., Талла А., Филали А., Рейлкар Р. и др.Воспаление перед вакцинацией и передача сигналов B-клеток предсказывают возрастную гипорефлексию на вакцинацию против гепатита B. Nat Commun. (2016) 7: 10369. DOI: 10.1038 / ncomms10369
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. де Алвис Р., Бельтрамелло М., Мессер В. Б., Сукуполви-Петти С., Вахала В. М., Краус А. и др. Углубленный анализ ответа антител у лиц, инфицированных первичным вирусом денге. PLoS Negl Trop Dis. (2011) 5: e1188.DOI: 10.1371 / аннотация / f585335f-ff77-40ae-a8b6-ad6019af31aa
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Такада А., Эбихара Х., Фельдманн Х., Гейсберт Т.В., Каваока Ю. Эпитопы, необходимые для антителозависимого усиления инфекции вирусом Эбола. J Infect Dis. (2007) 196 (Дополнение 2): S347–56. DOI: 10.1086 / 520581
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Лунд О., Хансен Дж., Соренсен А. М., Мосекилде Е., Нильсен Дж. О., Хансен Дж. Э..Повышенная адгезия как механизм антителозависимого и независимого от антител комплемент-опосредованного усиления инфекции вируса иммунодефицита человека. J Virol. (1995) 69: 2393–400. DOI: 10.1128 / JVI.69.4.2393-2400.1995
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Гиран И., Тьяги С.Р., Кликштейн Л.Б., Николсон-Веллер А. Экспрессия и функция рецепторов C1q и связывающих белков C1q на поверхности клетки. Иммунобиология. (2002) 205: 407–20.DOI: 10.1078 / 0171-2985-00142
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Ван И, Шан Дж, Сан С., Тай В., Чен Дж, Гэн Кью и др. Молекулярный механизм антителозависимого усиления проникновения коронавируса. J Virol. (2020) 94, 1–15. DOI: 10.1128 / JVI.02015-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Mason PW, Rieder E, Baxt B. Последовательность RGD вируса ящура важна для инфицирования клеток через естественный рецептор, но ее можно обойти с помощью антителозависимого пути усиления. Proc Natl Acad Sci USA. (1994) 91: 1932–6. DOI: 10.1073 / pnas.91.5.1932
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Chareonsirisuthigul T, Kalayanarooj S, Ubol S. Зависящее от антител к вирусу денге (DENV) усиление инфекции усиливает выработку противовоспалительных цитокинов, но подавляет выработку свободных радикалов анти-DENV и выработку провоспалительных цитокинов в THP-1 клетки. J Gen Virol. (2007) 88: 365–75. DOI: 10.1099 / vir.0,82537-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Дейнираттисай В., Джумнайнсонг А., Онсирисакул Н., Фиттон П., Васанаватана С., Лимпитикул В. и др. Перекрестно реагирующие антитела усиливают инфицирование людей вирусом денге. Наука. (2010) 328: 745–8. DOI: 10.1126 / science.1185181
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Риполл Д. Р., Валквист А., Чаудхури С. Молекулярное моделирование показывает роль тонкой специфичности антител и состояния созревания вируса в зависимом от антител усилении инфекции вируса денге. Front Cell Infect Microbiol. (2019) 9: 200. DOI: 10.3389 / fcimb.2019.00200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Kliks SC, Nisalak A, Brandt WE, Wahl L, Burke DS. Антителозависимое усиление роста вируса денге в моноцитах человека как фактор риска геморрагической лихорадки денге. Am J Trop Med Hyg. (1989) 40: 444–51. DOI: 10.4269 / ajtmh.1989.40.444
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84.Sangkawibha N, Rojanasuphot S, Ahandrik S, Viriyapongse S, Jatanasen S, Salitul V, et al. Факторы риска шокового синдрома денге: проспективное эпидемиологическое исследование в Районге, Таиланд: I. Вспышка 1980 года. Am J Epidemiol. (1984) 120: 653–69. DOI: 10.1093 / oxfordjournals.aje.a113932
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Монтесилло-Агуадо М.Р., Монтес-Гомес А.Э., Гарсия-Кордеро Дж., Корсо-Гомес Дж., Виванко-Сид Х., Мелладо-Санчес Дж. И др. Перекрестная реакция, усиление и нейтрализация активности антител вируса денге против вируса Зика: исследование в мексиканской популяции. J Immunol Res. (2019) 2019: 7239347. DOI: 10.1155 / 2019/7239347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Сирохи Д., Чен З., Сан Л., Клозе Т., Пирсон Т.С., Россманн М.Г. и др. КриоЭМ-структура вируса Зика с разрешением 3,8 Å. Наука. (2016) 352: 467–70. DOI: 10.1126 / science.aaf5316
CrossRef Полный текст | Google Scholar
87. Ногейра М.Л., Хуниор Н.Н., Эстофолет С.Ф., Терциан А.Б., Гимарайнш ГдФ, Зини Н. и др.Неблагоприятные исходы родов, связанные с воздействием вируса Зика во время беременности, в Сан-Жозе-ду-Риу-Прету, Бразилия. Clin Microbiol Infect. (2018) 24: 646–52. DOI: 10.1016 / j.cmi.2017.11.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Кацельник Л.С., Монтойя М., Греш Л., Бальмаседа А., Харрис Э. Титры нейтрализующих антител против вируса денге коррелируют с защитой от симптоматической инфекции в продольной когорте. Proc Natl Acad Sci USA. (2016) 113: 728–33. DOI: 10.1073 / pnas.1522136113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Havenar-Daughton C, Newton IG, Zare SY, Reiss SM, Schwan B, Suh MJ, et al. Доступ к нормальным Т-фолликулярным вспомогательным клеткам лимфатических узлов человека и В-клеткам зародышевого центра осуществляется с помощью аспирации тонкой иглой. Дж. Иммунол Методы . (2020) 479: 112746. DOI: 10.1016 / j.jim.2020.112746
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92.Симпсон Н., Гейтенби П.А., Уилсон А., Малик С., Фулчер Д.А., Танге С.Г. и др. Увеличение циркулирующих Т-клеток, напоминающих фолликулярные Т-хелперы, является фиксированным фенотипом, который определяет подмножество тяжелой системной красной волчанки. Arthritis Rheum. (2010) 62: 234–44. DOI: 10.1002 / art.25032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Бентебибель С.Е., Лопес С., Обермозер Дж., Шмитт Н., Мюллер С., Харрод С. и др. Индукция клеток ICOS + CXCR3 + CXCR5 + TH коррелирует с реакциями антител на вакцинацию против гриппа. Sci Transl Med. (2013) 5: 176ra32. DOI: 10.1126 / scitranslmed.3005191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. He J, Tsai LM, Leong YA, Hu X, Ma CS, Chevalier N, et al. Циркулирующие предшественники CCR7loPD-1hi CXCR5 + CD4 + Т-клетки указывают на активность клеток Tfh и стимулируют ответы антител при повторном воздействии антигена. Иммунитет. (2013) 39: 770–81. DOI: 10.1016 / j.immuni.2013.09.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96.Морита Р., Шмитт Н., Бентебибель С.Е., Ранганатан Р., Бурдери Л., Зуравски Г. и др. CXCR5 (+) CD4 (+) Т-клетки крови человека являются аналогами Т-фолликулярных клеток и содержат специфические подмножества, которые по-разному поддерживают секрецию антител. Иммунитет. (2011) 34: 108–21. DOI: 10.1016 / j.immuni.2011.01.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Locci M, Havenar-Daughton C, Landais E, Wu J, Kroenke MA, Arlehamn CL, et al. Циркулирующие человеческие клетки памяти Tfh PD-1 + CXCR3-CXCR5 + обладают высокой функциональностью и коррелируют с широко нейтрализующими ответами антител к ВИЧ. Иммунитет. (2013) 39: 758–69. DOI: 10.1016 / j.immuni.2013.08.031
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Victora GD, Schwickert TA, Fooksman DR, Kamphorst AO, Meyer-Hermann M, Dustin ML, et al. Динамика зародышевого центра обнаружена с помощью многофотонной микроскопии с фотоактивируемым флуоресцентным репортером. Cell. (2010) 143: 592–605. DOI: 10.1016 / j.cell.2010.10.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99.Haltaufderhyde K, Srikiatkhachorn A, Green S, Macareo L, Park S, Kalayanarooj S и др. Активация периферических Т-фолликулярных вспомогательных клеток во время острой инфекции вируса денге. J Infect Dis. (2018) 218: 1675–85. DOI: 10.1093 / infdis / jiy360
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Мартинес-Навио Дж. М., Казанова В., Пачеко Р., Навал-Макабухай I, Климент Н., Гарсия Ф. и др. Аденозиндезаминаза усиливает образование эффекторных, запоминающих и регуляторных Т-лимфоцитов CD4 +. J Leuk Biol. (2011) 89: 127–36. DOI: 10.1189 / jlb.1009696
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Брэдфорд К.Л., Моретти Ф.А., Карбонаро-Саррачино Д.А., Гаспар Н.Б., Кон Д.Б. Тяжелый комбинированный иммунодефицит (ТКИД) с дефицитом аденозиндезаминазы (ADA): молекулярный патогенез и клинические проявления. J Clin Immunol. (2017) 37: 626–37. DOI: 10.1007 / s10875-017-0433-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102.Тардиф В., Мюир Р., Кубас Р., Чахтоура М., Уилкинсон П., Меткалф Т. и др. Аденозиндезаминаза-1 определяет функцию Т-хелперных фолликулярных клеток человека и изменяется с ВИЧ. Nat Commun. (2019) 10: 1–15. DOI: 10.1038 / s41467-019-08801-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Фарук Ф, Бек К., Паолино К.М., Филлипс Р., Уотерс, Северная Каролина, Регулес Дж. А. и др. Циркулирующие фолликулярные Т-хелперы и профиль цитокинов у людей после вакцинации вакциной против вируса Эбола rVSV-ZEBOV. Научный доклад (2016) 6: 27944. DOI: 10.1038 / srep27944
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Riteau N, Radtke AJ, Shenderov K, Mittereder L, Oland SD, Hieny S, et al. Адъюванты, содержащие только воду в масле, избирательно способствуют поляризации Т-фолликулярных клеток-помощников посредством IFN и IL-6-зависимого пути I типа. J Immunol. (2016) 197: 3884–93. DOI: 10.4049 / jimmunol.1600883
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105.Гавилле Б.М., Эберхард С.С., Одерсет Ф., Кастеллино Ф., Зеуберт А., Трегонинг Дж. С. и др. MF59 опосредует свою В-клеточную адъювантность, стимулируя Т-фолликулярные хелперные клетки и, таким образом, ответы зародышевого центра во взрослом и раннем возрасте. J Immunol. (2015) 194: 4836–45. DOI: 10.4049 / jimmunol.1402071
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Kasturi SP, Skountzou I., Albrecht RA, Koutsonanos D, Hua T., Nakaya HI, et al. Программирование величины и устойчивости ответов антител при врожденном иммунитете. Природа. (2011) 470: 543–7. DOI: 10.1038 / nature09737
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Ян Х, Ян Дж, Чу Й, Сюэ У, Сюань Д., Чжэн С. и др. Т-фолликулярные хелперы и динамика регуляторных В-клеток при системной красной волчанке. PLoS ONE. (2014) 9, 1–9. DOI: 10.1371 / journal.pone.0088441
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Ван Дж., Шань Й., Цзян Цз., Фенг Дж., Ли К., Ма Л. и др.Высокая частота активированных В-клеток и Т-фолликулярных вспомогательных клеток коррелирует с активностью заболевания у пациентов с впервые возникшим ревматоидным артритом. Clin Exp Immunol. (2013) 174: 212–20. DOI: 10.1111 / cei.12162
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Кристенсен Дж. Р., Бёрнсен Л., Ратцер Р., Пил Ф., Хадеми М., Олссон Т. и др. Системное воспаление при прогрессирующем рассеянном склерозе включает фолликулярные Т-хелперы, Th27- и активированные В-клетки и коррелирует с прогрессированием. PLoS ONE. (2013) 8: e57820. DOI: 10.1371 / journal.pone.0057820
CrossRef Полный текст | Google Scholar
110. Линтерман М.А., Ригби Р.Дж., Вонг Р.К., Ю.Д., Бринк Р., Кэннонс Д.Л. и др. Фолликулярные Т-хелперы необходимы для системного аутоиммунитета. J Exp Med. (2009) 206: 561–76. DOI: 10.1084 / jem.20081886
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Какова роль вакцинации в профилактике лихорадки денге?
Всемирная организация здравоохранения.Информационный бюллетень о денге и тяжелой денге. КТО. Доступно на http://www.who.int/mediacentre/factsheets/fs117/en/. Апрель 2017 г .; Доступ: 28 сентября 2017 г.
Bhatt S, Gething PW, Brady OJ, Messina JP, Farlow AW, Moyes CL, et al. Глобальное распространение и бремя денге. Природа . 2013, 25 апреля. 496 (7446): 504-7. [Медлайн].
Brady OJ, Gething PW, Bhatt S, Messina JP, Brownstein JS, Hoen AG и др. Уточнение глобальных пространственных ограничений передачи вируса денге на основе консенсуса на основе фактических данных. PLoS Negl Trop Dis . 2012. 6 (8): e1760. [Медлайн].
Wilson ME, Chen LH. Денге: последние данные по эпидемиологии. Curr Infect Dis Rep . 2015 17 января (1): 457. [Медлайн].
Десять угроз глобальному здоровью в 2019 г. Всемирная организация здравоохранения. Доступно по адресу https://www.who.int/emergencies/ten-threats-to-global-health-in-2019. 2019; Доступ: 2 февраля 2019 г.
Кайл Дж. Л., Харрис Э. Глобальное распространение и стойкость денге. Анну Рев Микробиол . 2008. 62: 71-92. [Медлайн].
Statler J, Mammen M, Lyons A, Sun W. Сонографические данные здоровых добровольцев, инфицированных вирусом денге. J Clin Ультразвук . 2008 Сентябрь, 36 (7): 413-7. [Медлайн].
Гублер DJ. В городах распространяются эпидемические вирусы денге. Нат Мед . 2004 г., 10 (2): 129-30. [Медлайн].
Уайлдер-Смит А., Габлер DJ. Географическая экспансия денге: влияние международных поездок. Мед Клин Норт Ам . 2008 ноябрь 92 (6): 1377-90, x. [Медлайн].
Messina JP, Brady OJ, Scott TW, Zou C, Pigott DM, Duda KA, et al. Глобальное распространение типов вируса денге: картирование 70-летней истории. Trends Microbiol . 2014 марта 22 (3): 138-46. [Медлайн]. [Полный текст].
Halstead SB. Денге. Ланцет . 2007 10 ноября. 370 (9599): 1644-52. [Медлайн].
Chowell G, Torre CA, Munayco-Escate C, Suárez-Ognio L, López-Cruz R, Hyman JM.Пространственная и временная динамика лихорадки денге в Перу: 1994-2006 гг. Эпидемиологическая инфекция . 2008 декабрь 136 (12): 1667-77. [Медлайн].
Остервелл Н. Денге «Недооценка» в качестве источника лихорадочного заболевания в США. Медицинские новости Medscape. 23 января 2014 г. Доступно по адресу http://www.medscape.com/viewarticle/819656. Доступ: 25 января 2014 г.
Sharp TM, Gaul L, Muehlenbachs A, Hunsperger E, Bhatnagar J, Lueptow R, et al. Смертельный гемофагоцитарный лимфогистиоцитоз, связанный с местной инфекцией вируса денге — Нью-Мексико и Техас, 2012 г. MMWR Morb Mortal Wkly Rep . 2014 24 января. 63 (3): 49-54. [Медлайн].
Фридман Д.О., Велд Л.Х., Козарский П.Е., Фиск Т., Робинс Р., фон Зонненбург Ф. Спектр заболеваний и связь с местом заражения среди больных, вернувшихся путешественников. N Engl J Med . 2006 12 января. 354 (2): 119-30. [Медлайн].
Лю-Хелмерссон Дж., Куам М., Уайлдер-Смит А., Стенлунд Х., Эби К., Массад Э и др. Изменение климата и переносчики Aedes: прогнозы передачи денге в Европе на XXI век. EBioMedicine . 2016 май. 7: 267-77. [Медлайн].
CDC. Денге завезенная — США, 1997 и 1998 годы. MMWR Morb Mortal Wkly Rep . 2000 31 марта, 49 (12): 248-53. [Медлайн]. [Полный текст].
Engelthaler DM, Fink TM, Levy CE, Leslie MJ. Возрождение Aedes aegypti в Аризоне. Emerg Infect Dis . 1997 апр-июн. 3 (2): 241-2. [Медлайн]. [Полный текст].
Chye JK, Lim CT, Ng KB, et al.Вертикальная передача денге. Clin Infect Dis . 1997 25 декабря (6): 1374-7. [Медлайн].
Wagner D, de With K, Huzly D, Hufert F, Weidmann M, Breisinger S, et al. Нозокомиальное заражение лихорадкой денге. Emerg Infect Dis . 2004 октября 10 (10): 1872-3. [Медлайн].
Dejnirattisai W., Duangchinda T., Lin CL, Vasanawathana S, Jones M, Jacobs M, et al. Сложное взаимодействие между вирусом, дендритными клетками, Т-клетками и цитокинами при инфекциях, вызванных вирусом денге. Дж Иммунол . 2008 г. 1. 181 (9): 5865-74. [Медлайн].
Halstead SB, Heinz FX, Barrett AD, Roehrig JT. Вирус денге: молекулярные основы проникновения клеток и патогенеза, 25-27 июня 2003 г., Вена, Австрия. Вакцина . 2005, 4 января, 23 (7): 849-56. [Медлайн].
Лимджиндапорн Т., Вонгвиват В., Нойсакран С., Срисават С., Нетсаванг Дж., Путтихунт С. и др. Взаимодействие белка оболочки вируса денге с резидентными шаперонами эндоплазматического ретикулума способствует образованию вируса денге. Biochem Biophys Res Commun . 2009 6 февраля. 379 (2): 196-200. [Медлайн].
Zhang JL, Wang JL, Gao N, Chen ZT, Tian YP, An J. Повышенная регуляция экспрессии интегрина бета3, индуцированная инфекцией серотипа 2 вируса денге, связанной с проникновением вируса в эндотелиальные клетки микрососудов кожи человека. Biochem Biophys Res Commun . 2007 г. 11 мая. 356 (3): 763-8. [Медлайн].
Ротман А.Л., Эннис Ф.А. Иммунопатогенез геморрагической лихорадки Денге. Вирусология . 1999 25 апреля. 257 (1): 1-6. [Медлайн].
Chen LC, Lei HY, Liu CC, Shiesh SC, Chen SH, Liu HS. Корреляция сывороточных уровней фактора ингибирования миграции макрофагов с тяжестью заболевания и клиническим исходом у пациентов с денге. Ам Дж. Троп Мед Хиг . 2006 Январь 74 (1): 142-7. [Медлайн].
Грин С., Ротман А. Иммунопатологические механизмы денге и геморрагической лихорадки денге. Curr Opin Infect Dis .2006 Октябрь 19 (5): 429-36. [Медлайн].
Гусман М.Г., Альварес М., Родригес-Рош Р., Бернардо Л., Монтес Т., Васкес С. Нейтрализующие антитела после заражения вирусом денге 1. Emerg Infect Dis . 2007 13 февраля (2): 282-6. [Медлайн].
Restrepo BN, Ramirez RE, Arboleda M, Alvarez G, Ospina M, Diaz FJ. Уровни цитокинов в сыворотке крови у двух этнических групп, инфицированных вирусом денге. Ам Дж. Троп Мед Хиг . 2008 ноябрь 79 (5): 673-7.[Медлайн].
Ротман АЛ. Денге: определение защитного иммунитета против патологического. Дж. Клин Инвест . 2004 апр. 113 (7): 946-51. [Медлайн].
de Macedo FC, Nicol AF, Cooper LD, Yearsley M, Pires AR, Nuovo GJ. Гистологические, вирусные и молекулярные корреляты инфекции печени лихорадкой денге с использованием высокочувствительной иммуногистохимии. Диагноз Мол Патол . 2006 15 декабря (4): 223-8. [Медлайн].
Шах И.Денге и болезни печени. Scand J Infect Dis . 2008. 40 (11-12): 993-4. [Медлайн].
Dejnirattisai W., Jumnainsong A, Onsirisakul N, et al. Перекрестно реагирующие антитела усиливают инфицирование людей вирусом денге. Наука . 2010 7 мая. 328 (5979): 745-8. [Медлайн].
Schmidt AC. Реакция на лихорадку денге — хорошая, плохая и уродливая ?. N Engl J Med . 29 июля 2010 г. 363 (5): 484-7. [Медлайн].
Kurane I, Innis BL, Nimmannitya S, Nisalak A, Meager A, Ennis FA.Высокий уровень интерферона альфа в сыворотке крови детей, инфицированных вирусом денге. Ам Дж. Троп Мед Хиг . 1993, февраль, 48 (2): 222-9. [Медлайн].
Оджа А., Нанди Д., Батра Х., Сингхал Р., Аннарапу Г.К., Бхаттачарья С. и др. Активация тромбоцитов определяет тяжесть тромбоцитопении при инфекции денге. Научная репутация . 2017 31 января. 7: 41697. [Медлайн].
Hottz ED, Oliveira MF, Nunes PC, Nogueira RM, Valls-de-Souza R, Da Poian AT, et al.Денге вызывает активацию тромбоцитов, дисфункцию митохондрий и гибель клеток посредством механизмов, которые включают DC-SIGN и каспазы. J Thromb Haemost . 2013 май. 11 (5): 951-62. [Медлайн].
Ван Э, Ни Х, Сюй Р., Барретт А.Д., Ватович С.Дж., Гублер DJ. Эволюционные взаимосвязи эндемических / эпидемических и лесных вирусов денге. Дж Вирол . 2000 апр. 74 (7): 3227-34. [Медлайн].
Веб-сайт центров по контролю и профилактике заболеваний.Страница здоровья путешественника CDC. Денге. Доступно на http://www.cdc.gov/Dengue/travelOutbreaks/. Доступ: 20 октября 2011 г.
Chen WS, Wong CH, Cillekens L. Антитела денге в пригороде в Малайзии. Med J Malaysia . 2003 Март 58 (1): 142-3. [Медлайн].
Истурис Р. Э., Габлер Д. Д., Бреа дель Кастильо Дж. Денге и геморрагическая лихорадка денге в Латинской Америке и Карибском бассейне. Инфекция Dis Clin North Am . 2000 Март.14 (1): 121-40, ix. [Медлайн].
Hotez PJ, Bottazzi ME, Franco-Paredes C, Ault SK, Periago MR. Забытые тропические болезни Латинской Америки и Карибского бассейна: обзор бремени болезней и их распространения и дорожная карта по контролю и ликвидации. PLoS Negl Trop Dis . 2008 24 сентября 2 (9): e300. [Медлайн]. [Полный текст].
Центры по контролю и профилактике заболеваний (CDC). Эпиднадзор за лихорадкой денге, связанной с путешествиями — США, 2006–2008 гг. MMWR Morb Mortal Wkly Rep . 18 июня 2010 г. 59 (23): 715-9. [Медлайн]. [Полный текст].
Центры по контролю и профилактике заболеваний (CDC). Денге приобретено на месте — Ки-Уэст, Флорида, 2009-2010 гг. MMWR Morb Mortal Wkly Rep . 2010 21 мая. 59 (19): 577-81. [Медлайн].
Рей JR. Денге во Флориде (США). Насекомые . 2014 16 декабря. 5 (4): 991-1000. [Медлайн].
Malavige GN, Fernando S, Fernando DJ, Seneviratne SL.Вирусные инфекции денге. Постградская медицина J . 2004 окт. 80 (948): 588-601. [Медлайн]. [Полный текст].
Стивенсон-младший. Понимание патогенеза денге: значение для разработки вакцины. Орган здоровья Bull World . 2005 апр. 83 (4): 308-14. [Медлайн]. [Полный текст].
Всемирная организация здравоохранения. Влияние денге. Доступно по адресу http://www.who.int/csr/disease/dengue/impact/en/index.html. Дата обращения: 14 октября 2011 г.
Bhatt S, Gething PW, Brady OJ, Messina JP, Farlow AW, Moyes CL, et al.Глобальное распространение и бремя денге. Природа . 2013, 25 апреля. 496 (7446): 504-7. [Медлайн].
Brady OJ, Gething PW, Bhatt S, Messina JP, Brownstein JS, Hoen AG и др. Уточнение глобальных пространственных ограничений передачи вируса денге на основе консенсуса на основе фактических данных. PLoS Negl Trop Dis . 2012. 6 (8): e1760. [Медлайн].
Lin CC, Huang YH, Shu PY, et al. Характеристика болезни денге на Тайване: 2002-2007 гг. Ам Дж. Троп Мед Хиг . 2010 апр. 82 (4): 731-9. [Медлайн]. [Полный текст].
Андерсон К.Б., Чунсуттиват С., Нисалак А., Маммен М.П., Либрати Д.Х., Ротман А.Л. Бремя симптоматической инфекции денге у детей в начальной школе в Таиланде: проспективное исследование. Ланцет . 2007, 28 апреля. 369 (9571): 1452-9. [Медлайн].
Анкер М., Арима Ю. Различия между мужчинами и женщинами в количестве зарегистрированных случаев лихорадки денге в шести азиатских странах. Western Pac Surveill Response J . 2011 Апрель 2 (2): 17-23. [Медлайн].
Lahiri M, Fisher D, Tambyah PA. Смертность от денге: переоценка рисков в странах с переходной экономикой. Trans R Soc Trop Med Hyg . 2008 Октябрь 102 (10): 1011-6. [Медлайн].
Beatty ME, Beutels P, Meltzer MI, et al. Экономика здравоохранения лихорадки денге: систематический обзор литературы и оценка экспертной группы. Ам Дж. Троп Мед Хиг . 2011 Март.84 (3): 473-88. [Медлайн]. [Полный текст].
Shepard DS, Coudeville L, Halasa YA, Zambrano B, Dayan GH. Экономические последствия болезни денге в Северной и Южной Америке. Ам Дж. Троп Мед Хиг . 2011 Февраль 84 (2): 200-7. [Медлайн]. [Полный текст].
Суая Дж. А., Шепард Д. С., Сикейра Дж. Б. и др. Стоимость случаев денге в восьми странах Северной и Южной Америки и Азии: проспективное исследование. Ам Дж. Троп Мед Хиг . 2009 Май. 80 (5): 846-55. [Медлайн].
ВОЗ.Геморрагическая лихорадка денге: диагностика, лечение, профилактика и борьба. Всемирная организация здравоохранения . 1997. Доступно по адресу http://www.who.int/topics/dengue/en/.
Sanjay S, Wagle AM, Au Eong KG. Оптическая нейропатия денге. Офтальмология . 2009 январь, 116 (1): 170; ответ автора 170. [Medline].
Тевес Мария А. Неправильное лечение — наиболее частая причина смерти от денге. Новости ABS / CBN. Доступно по адресу http://www.abs-cbnnews.com/nation/09/03/09/wrong-treatment-most-common-cause-dengue-fatality.Доступ: 3 сентября 2010 г.
Bottieau E, Clerinx J, Van den Enden E, Van Esbroeck M, Colebunders R, Van Gompel A. Лихорадка после пребывания в тропиках: диагностические предикторы ведущих тропических условий. Медицина (Балтимор) . 2007 Январь 86 (1): 18-25. [Медлайн].
Malhotra N, Chanana C, Kumar S. Инфекция денге во время беременности. Int J Gynaecol Obstet . 2006 август 94 (2): 131-2. [Медлайн].
Сингх Н., Шарма К.А., Дадхвал В., Миттал С., Сельви А.С.Успешное ведение лихорадки денге во время беременности: отчет о двух случаях. Индийский журнал J Med Microbiol . 2008 окт-дек. 26 (4): 377-80. [Медлайн].
Warrilow D, Northill JA, Pyke A, Smith GA. Единый экспресс-анализ ПЦР с флуорогенным зондом TaqMan, который выявляет все четыре серотипа денге. J Med Virol . 2002 апр. 66 (4): 524-8. [Медлайн].
Kong YY, Thay CH, Tin TC, Devi S. Быстрое обнаружение, серотипирование и количественное определение вирусов денге с помощью TaqMan одноэтапной ОТ-ПЦР в реальном времени. Дж. Вирольные методы . 2006 декабрь 138 (1-2): 123-30. [Медлайн].
Trung DT, Thao le TT, Hien TT и др. Поражение печени, связанное с инфекцией денге, у взрослых во Вьетнаме. Ам Дж. Троп Мед Хиг . 2010 Октябрь 83 (4): 774-80. [Медлайн]. [Полный текст].
Potts JA, Rothman AL. Клинические и лабораторные особенности, отличающие лихорадку денге от других лихорадочных заболеваний в эндемичных популяциях. Троп Мед Инт Хелс . 2008 ноя.13 (11): 1328-40. [Медлайн]. [Полный текст].
Lima EQ, Nogueira ML. Острое повреждение почек, вызванное вирусной геморрагической лихорадкой. Семин Нефрол . 2008 июл.28 (4): 409-15. [Медлайн].
Lombardi R, Yu L, Younes-Ibrahim M, Schor N, Burdmann EA. Эпидемиология острого повреждения почек в Латинской Америке. Семин Нефрол . 2008 июл.28 (4): 320-9. [Медлайн].
Чатерджи С., Аллен Дж. С. младший, Чоу А., Лео Ю.С., Оои Э.Оценка экспресс-теста NS1 и схем классификации денге ВОЗ для использования в качестве прикроватной диагностики острой лихорадки денге у взрослых. Ам Дж. Троп Мед Хиг . 2011 Февраль 84 (2): 224-8. [Медлайн]. [Полный текст].
Wichmann O, Stark K, Shu PY, Niedrig M, Frank C, Huang JH. Клинические особенности и подводные камни лабораторной диагностики лихорадки денге у путешественников. BMC Infect Dis . 2006. 6: 120. [Медлайн].
Доминго К., де Ори Ф., Санс Дж. К., Рейес Н., Гаскон Дж., Вичманн О. и др.Молекулярные и серологические маркеры острой инфекции лихорадки денге у путешественников, ранее не прошедших вакцинацию, и путешественников, вакцинированных флавивирусом. Диагностика Microbiol Infect Dis . 2009 Сентябрь 65 (1): 42-8. [Медлайн].
Srikiatkhachorn A, Krautrachue A, Ratanaprakarn W, Wongtapradit L, Nithipanya N, Kalayanarooj S. Естественная история утечки плазмы при геморрагической лихорадке денге: серийное ультразвуковое исследование. Pediatr Infect Dis J . 2007 апреля, 26 (4): 283–90; обсуждение 291-2. [Медлайн].
Сантош В.Р., Патил П.Г., Сринат М.Г., Кумар А., Джайн А., Арчана М.Сонография в диагностике и оценке лихорадки денге. J Clin Imaging Sci . 2014. 4:14. [Медлайн]. [Полный текст].
Srikiatkhachorn A, Gibbons RV, Green S, et al. Геморрагическая лихорадка денге: чувствительность и специфичность определения Всемирной организации здравоохранения для выявления тяжелых случаев денге в Таиланде, 1994–2005 гг. Clin Infect Dis . 15 апреля 2010 г. 50 (8): 1135-43. [Медлайн]. [Полный текст].
Setiati TE, Mairuhu AT, Koraka P, Supriatna M, Mac Gillavry MR, Brandjes DP, et al.Тяжесть болезни денге у индонезийских детей: оценка системы классификации Всемирной организации здравоохранения. BMC Infect Dis . 26 марта 2007 г., 7:22. [Медлайн]. [Полный текст].
Tassniyom S, Vasanawathana S, Chirawatkul A, Rojanasuphot S. Отсутствие высоких доз метилпреднизолона при установленном шоковом синдроме денге: плацебо-контролируемое двойное слепое исследование. Педиатрия . 1993 июл.92 (1): 111-5. [Медлайн].
ВОЗ.Денге. Доступно по адресу http://www.who.int/topics/dengue/en/. Доступ: 20 октября 2011 г.
Wills BA, Nguyen MD, Ha TL, Dong TH, Tran TN, Le TT и др. Сравнение трех жидких растворов для реанимации при шоковом синдроме денге. N Engl J Med . 2005 сентябрь 1. 353 (9): 877-89. [Медлайн].
Ядав С.П., Сачдева А., Гупта Д., Шарма С.Д., Харья Г. Контроль массивного кровотечения при геморрагической лихорадке денге с тяжелой тромбоцитопенией с помощью внутривенного введения анти-D глобулина. Рак крови у детей . 2008 декабрь 51 (6): 812-3. [Медлайн].
Waduge R, Malavige GN, Pradeepan M, Wijeyaratne CN, Fernando S, Seneviratne SL. Инфекции денге во время беременности: серия случаев из Шри-Ланки и обзор литературы. Дж. Клин Вирол . 2006 Сентябрь 37 (1): 27-33. [Медлайн].
Исмаил Н.А., Кампан Н., Махди З.А., Джамиль М.А., Рази З.Р. Денге при беременности. Юго-Восточная Азия J Trop Med Public Health .2006 июл. 37 (4): 681-3. [Медлайн].
Billingsley PF, Foy B, Rasgon JL. Москитоцидные вакцины: игнорируемое дополнение к стратегиям борьбы с малярией и денге. Trends Parasitol . 2008 24 сентября (9): 396-400. [Медлайн].
Erlanger TE, Keizer J, Utzinger J. Влияние вмешательств по борьбе с переносчиками денге на энтомологические параметры в развивающихся странах: систематический обзор и метаанализ. Мед Ветеринар Энтомол . 2008 сен.22 (3): 203-21. [Медлайн].
Кей Б., Ву С.Н. Новая стратегия против Aedes aegypti во Вьетнаме. Ланцет . 2005 12-18 февраля. 365 (9459): 613-7. [Медлайн].
Hanh TT, Hill PS, Kay BH, Quy TM. Разработка основы для оценки устойчивости проектов борьбы с лихорадкой денге на уровне сообществ. Ам Дж. Троп Мед Хиг . 2009 Февраль 80 (2): 312-8. [Медлайн].
Hoffmann AA, Montgomery BL, Popovici J, Iturbe-Ormaetxe I, Johnson PH, Muzzi F, et al.Успешное внедрение Wolbachia в популяциях Aedes для подавления передачи денге. Природа . 2011 24 августа. 476 (7361): 454-7. [Медлайн].
Ланг Дж. Последние достижения в области разработки вакцины против лихорадки денге санофи пастер. Дж. Клин Вирол . 2009 г., 46, Приложение 2: S20-4. [Медлайн].
Всемирная организация здравоохранения. Вакцина против денге: позиционный документ ВОЗ — июль 2016 г. Wkly Epidemiol Rec . 2016 29 июля. 91 (30): 349-64.[Медлайн].
Aguiar M, Stollenwerk N, Halstead SB. Риски, стоящие за рекомендацией Dengvaxia. Ланцет Infect Dis . 2016 16 августа (8): 882-3. [Медлайн]. [Полный текст].
Dengvaxia. Европейское агентство по лекарственным средствам. Доступно на https://www.ema.europa.eu/en/medicines/human/EPAR/dengvaxia. 2018 Dec 18; Доступ: 15 февраля 2019 г.
Dengvaxia (вакцина против денге) [вкладыш в упаковке]. Свифтвотер, Пенсильвания: Санофи Пастер, Инк.Май 2019 г. Доступно в [Полный текст].
Monath TP. Денге и желтая лихорадка — проблемы для разработки и использования вакцин. N Engl J Med . 2007 29 ноября. 357 (22): 2222-5. [Медлайн].
McArthur JH, Durbin AP, Marron JA, Wanionek KA, Thumar B, Pierro DJ, et al. Фаза I клиническая оценка rDEN4Delta30-200,201: живая аттенуированная вакцина-кандидат от денге 4, разработанная для снижения гепатотоксичности. Ам Дж. Троп Мед Хиг .2008 ноябрь 79 (5): 678-84. [Медлайн]. [Полный текст].
О’Брайен Дж. 12-я ежегодная конференция по исследованиям вакцин. Вакцины Эксперт Рев . 2009 Сентябрь 8 (9): 1139-42. [Медлайн].
Вакцины Эдельмана Р. Денге приближаются к финишу. Clin Infect Dis . 2007 15 июля. 45 Приложение 1: S56-60. [Медлайн].
Блейни Дж. Э. Младший, Дурбин А. П., Мерфи Б. Р., Уайтхед СС. Разработка живой аттенуированной вакцины против вируса денге с использованием обратной генетики. Вирусный иммунол . 2006 Весна. 19 (1): 10-32. [Медлайн].
Вопросы и ответы о вакцинах против денге. Всемирная организация здравоохранения. Доступно по адресу https://www.who.int/immunization/research/development/dengue_q_and_a/en/. 2018 20 апреля; Дата обращения: 10 февраля 2019 г.
Ларсен С.П., Уайтхед СС, Дурбин А.П. Модели заражения людей денге для продвижения разработки вакцины против лихорадки денге. Вакцина . 2015 28 сентября. [Medline].
Анкер М., Арима Ю.Различия между мужчинами и женщинами в количестве зарегистрированных случаев лихорадки денге в шести азиатских странах. Western Pac Surveill Response J . 2011 Апрель 2 (2): 17-23. [Медлайн].

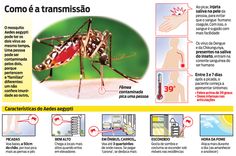
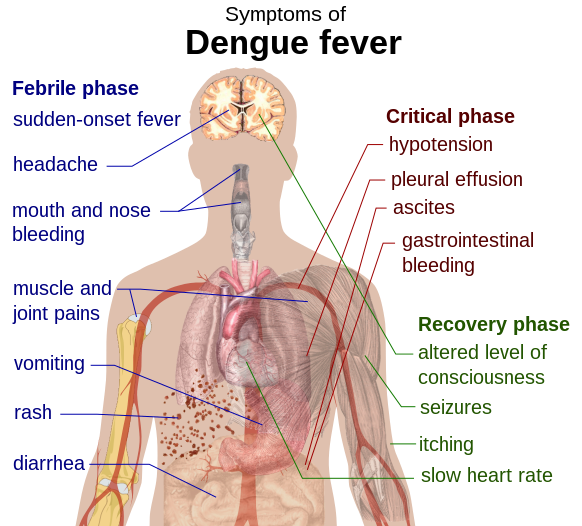 Вирусный Иммунол
13: 179–186 [PubMed] [Google Scholar]
Вирусный Иммунол
13: 179–186 [PubMed] [Google Scholar] , Тьяден Дж., Берджесс Т., Данко Дж., Тамминга К., Симмонс М. и др. (2011) Оценка прототипа ДНК-вакцины против лихорадки денге-1 в клинических испытаниях фазы 1. Вакцина
29: 960–968 [PubMed] [Google Scholar]
, Тьяден Дж., Берджесс Т., Данко Дж., Тамминга К., Симмонс М. и др. (2011) Оценка прототипа ДНК-вакцины против лихорадки денге-1 в клинических испытаниях фазы 1. Вакцина
29: 960–968 [PubMed] [Google Scholar] Мнение эксперта Biol Ther
11: 667–677 [PubMed] [Google Scholar]
Мнение эксперта Biol Ther
11: 667–677 [PubMed] [Google Scholar]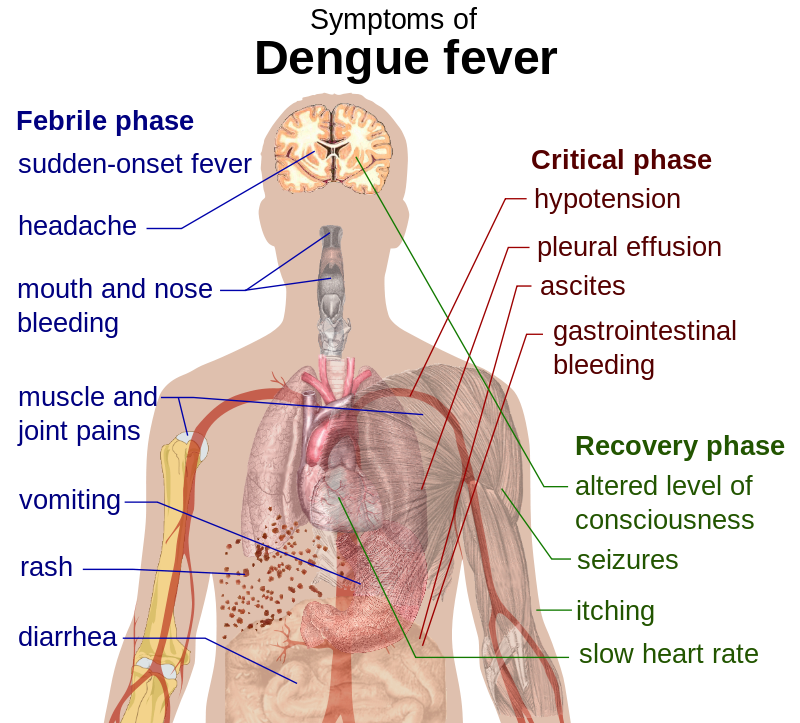 Am J Trop Med Гигиена
69: 5–11 [PubMed] [Google Scholar]
Am J Trop Med Гигиена
69: 5–11 [PubMed] [Google Scholar] Экспертные ревакцины
5: 803–825 [PubMed] [Google Scholar]
Экспертные ревакцины
5: 803–825 [PubMed] [Google Scholar] Вакцина
20: 1058–1067 [PubMed] [Google Scholar]
Вакцина
20: 1058–1067 [PubMed] [Google Scholar] J заразить Дис
197: 686–692 [Бесплатная статья PMC] [PubMed] [Google Scholar]
J заразить Дис
197: 686–692 [Бесплатная статья PMC] [PubMed] [Google Scholar] , Венк М., Хобарт П., Хоффман С., Хедстром Р. и др. (1999) Плазмидная ДНК-вакцина против малярии: исследования тканевого распределения и безопасности на мышах и кроликах.Хум Джин Тер
10: 741–758 [PubMed] [Google Scholar]
, Венк М., Хобарт П., Хоффман С., Хедстром Р. и др. (1999) Плазмидная ДНК-вакцина против малярии: исследования тканевого распределения и безопасности на мышах и кроликах.Хум Джин Тер
10: 741–758 [PubMed] [Google Scholar]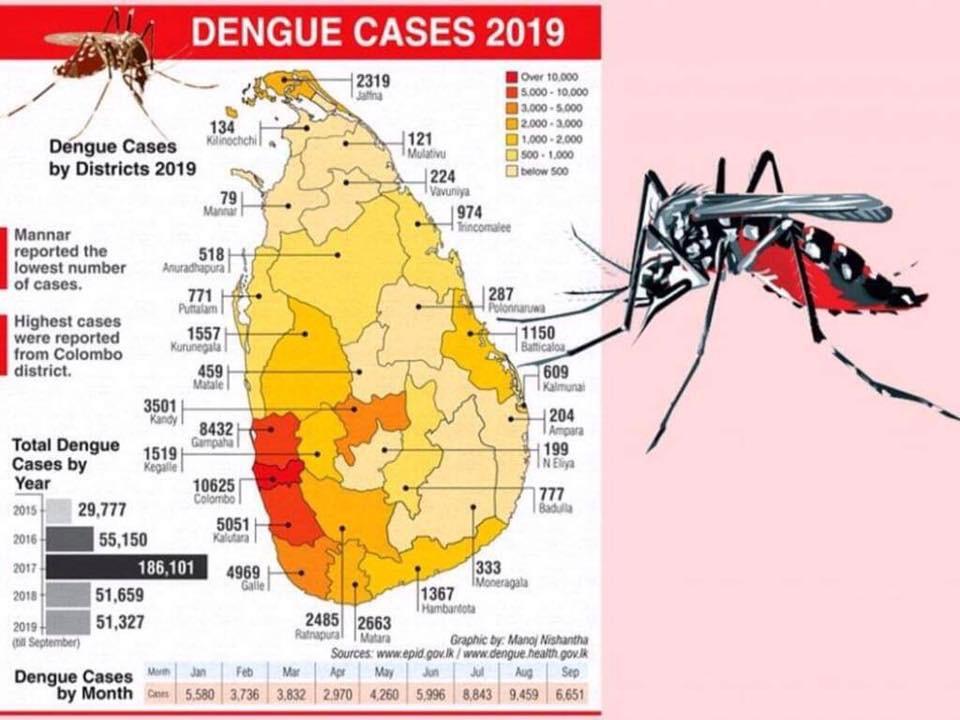 Вирусология
353: 166–173 [PubMed] [Google Scholar]
Вирусология
353: 166–173 [PubMed] [Google Scholar] , Chanthavanich P., Suvannadabba S., et al. (2012) Защитная эффективность рекомбинантной живой аттенуированной четырехвалентной вакцины против денге у тайских школьников: рандомизированное контролируемое испытание фазы 2b. Ланцет
380: 1559–1567 [PubMed] [Google Scholar]
, Chanthavanich P., Suvannadabba S., et al. (2012) Защитная эффективность рекомбинантной живой аттенуированной четырехвалентной вакцины против денге у тайских школьников: рандомизированное контролируемое испытание фазы 2b. Ланцет
380: 1559–1567 [PubMed] [Google Scholar] Вирусология
396: 280–288 [PubMed] [Google Scholar]
Вирусология
396: 280–288 [PubMed] [Google Scholar]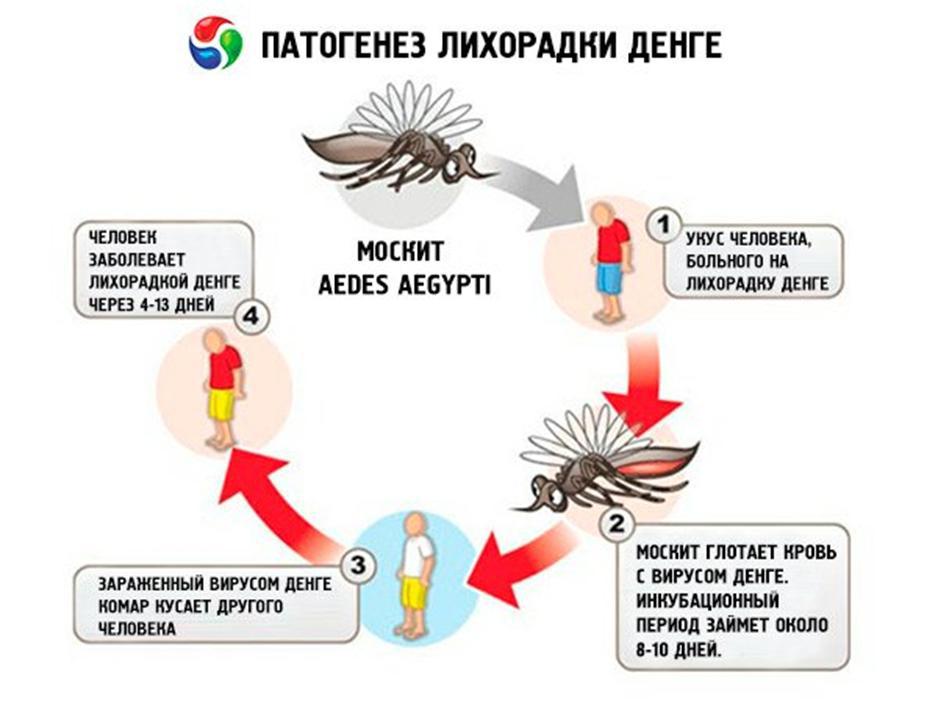 [Google Scholar]
[Google Scholar] Индия: Всемирная организация здравоохранения. Региональный офис для Юго-Восточной Азии [Google Scholar]
Индия: Всемирная организация здравоохранения. Региональный офис для Юго-Восточной Азии [Google Scholar]